Von Thomas Mehner, Roy Morgenstern, Ingolf Scharf und Thomas Lampke, Technische Universität Chemnitz, Professur Werkstoff- und Oberflächentechnik
Die Überwachung von Korrosionssystemen und die Bewertung von Schutzmaßnahmen erfordern praxisnahe Korrosionsprüfverfahren. Oftmals werden verschärfte Prüfbedingungen zur Reduzierung der Prüfdauer gewählt, jedoch beeinträchtigt dies die Aussagekraft der Untersuchungen. Wie im Folgenden gezeigt wird, kann die elektrochemische Impedanzspektroskopie hier Abhilfe schaffen: Anhand des Impedanzverhaltens können relevante Korrosionskenngrößen sowie Korrosionsraten und das zugehörige Zeitverhalten ermittelt werden. Am Beispiel des Walz- und Tiefziehstahls DC04 werden die Vorgehensweise und die Möglichkeiten des Verfahrens aufgezeigt. Großes Potenzial bietet die Methode beispielsweise bei der Charakterisierung von temporärem Korrosionsschutz.
The monitoring of corrosion systems and the evaluation of corrosion control efficiency require practical corrosion tests. Often, reinforced conditions are chosen for reducing the durations of the tests. However, these conditions compromise the significance of the investigations. As shown in the following, the electrochemical impedance spectroscopy can be an interesting alternative. Based on the impedance behavior, relevant corrosion parameters as well as corrosion rates and their change over time can be deduced. Using the example of the steel DC04, the approach and the possibilities of the method are demonstrated. Relevant applications include the characterization of measures for temporary corrosion control.
1 Einleitung
Die enorme wirtschaftliche Bedeutung der Korrosion zeigt sich bereits in den hohen direkten Kosten: Mehr als drei Billionen US-Dollar waren weltweit 2010 schätzungsweise erforderlich, um Korrosionsschäden zu beseitigen und die Werkstoffe vor Korrosion zu schützen [1]. Aussagekräftige Korrosionsprüfverfahren sind daher unabdingbar. Oftmals müssen dafür jedoch entweder lange Korrosionszeiten genutzt werden, sodass der Masseverlust hinreichend genau bestimmt werden kann. Alternativ können die Prüfbedingungen verschärft werden, sodass die Korrosion in kürzerer Zeit erfolgt. Diese Kurzzeit- beziehungsweise Schnelltests sind jedoch nur beschränkt auf reale Einsatzbedingungen übertragbar. Zu den letztgenannten zählen auch elektrochemische Methoden wie Stromdichte-Potenzial-Kurven, bei denen zur Bestimmung der Korrosionsstromdichte mittels Tafel-Geraden eine hohe Polarisation erforderlich ist. Abbildung 1 zeigt eine Stromdichte-Potenzial-Kurve mit typischen Tafel-Geraden, wie sie oft verwendet wird. Zu beachten ist hierbei jedoch, dass der Anstieg der Gerade über 1 bis 2 Größenordnungen der Stromdichte konstant sein muss [2], was in praktischen Messungen in vielen Fällen nicht beachtet wird. Das Anlegen der Tafel-Geraden ist zudem in gewissen Grenzen willkürlich. In der Folge entstehen große Schwankungen der Ergebnisse und die Vergleichbarkeit ist nicht gewährleistet. Auch können bei hoher Polarisation andere Prozesse ablaufen als im stromlosen Fall, die den Anstieg und damit die Korrosionskennwerte verfälschen.

Abb. 1: Tafel-Geraden im kathodischen (rot) und anodischen (blau) Bereich einer Stromdichte-Potenzial-Kurve; die erforderliche Konstanz ihres Anstiegs über 1 bis 2 Dekaden der Stromdichte ist trotz einer Polarisation von etwa 400 mV nicht gegeben
Bei der elektrochemischen Impedanzspektroskopie (EIS) kann im Gegensatz dazu auf diese hohe Polarisation verzichtet werden (fast außenstromlose Messung), sodass die Ergebnisse in hohem Maße praxisrelevant sind. Bei der EIS wird der komplexe Wechselstromwiderstand (Impedanz Z) der Probe untersucht. Sinusförmige Anregungsspannungen oder -stromstärken unterschiedlicher Frequenz bewirken eine sinusförmige Signalantwort der Probe. Von Interesse sind dabei der Quotient von komplexer Spannung U und komplexer Stromstärke I:
![]() <1>
<1>
sowie die Phasenverschiebung zwischen beiden Sinusfunktionen. Mit einem systemspezifischen Ersatzschaltbild können das reale physikalisch-chemische Verhalten modelliert und damit korrosionsrelevante Größen des Korrosionssystems quantifiziert sowie Korrosionsraten ermittelt werden [3]. Zudem können Informationen über Aufbau und Kapazität der elektrochemischen Doppelschicht, zur Passivierung sowie der wahren Größe der Probenoberfläche gewonnen werden [4].
2 Experimenteller Aufbau und Ergebnisse
Mithilfe der EIS wurde das Korrosionsverhalten von Stahlblechen aus dem Werkstoff DC04 in Schwefelsäure (pH 1,8, Temp. 25 °C) analysiert, die ausgehend von einer Blechdicke von 2,0 mm auf unterschiedliche Dicken gewalzt wurden. Bleche mit geringerer Dicke wiesen folglich höhere Umformgrade auf. Im Fokus stand dabei die Untersuchung des Zeitverlaufs der Korrosionsrate. Abbildung 2 zeigt den verwendeten Versuchsaufbau. Für die Messungen wurde eine elektrochemische Workstation (Zahner Zennium) verwendet.

Abb. 2: Verwendete Drei-Elektrodenmessanordnung für impedanzspektroskopische Messungen
Der Ablauf eines Messzyklus bestand aus den beiden Teilschritten:
- Messung des Ruhepotenzials für 10 min
- Messung eines Impedanzspektrums für 22 min (4 kHz bis 45 mHz mit fünf Frequenzen pro Dekade und 20 Messwiederholungen pro Frequenz)
Es wurden 30 Zyklen hintereinander gemessen, wodurch sich eine Gesamtmesszeit von circa 16 Stunden ergab. Dabei kam ein (pseudo-)galvanostatischer Modus (I = 0 A, d. h. beim Ruhepotenzial) mit einer Spannungsamplitude von 10 mV zum Einsatz. Die Auswertung der Messungen erfolgte mit dem in Abbildung 3 gezeigten Ersatzschaltbild. RE stellt den Elektrolytwiderstand dar, RD den Durchtrittswiderstand und CPE ist ein constant phase Element. Ein CPE stellt eine nicht-ideale Kapazität dar und bewirkt eine für alle Frequenzen konstante Phasenverschiebung zwischen 0° und -90°. Eine ideale Kapazität würde eine Phasenverschiebung von -90° verursachen.

Abb. 3: Ersatzschaltbild für die Parameterbestimmung der EIS-Messungen

Abb. 4: Beispielhafte Darstellung von Nyquist-Plots zweier Messungen, gemittelt aus jeweils vier Einzelmessungen für unterschiedliche Blechdicken (a) 2,0 mm, b) 0,5 mm) nach einer Korrosionsdauer von 2 h mit den zugehörigen simulierten Spektren
Mithilfe dieses Ersatzschaltbilds lassen sich die gemessenen EIS-Spektren anpassen (Abb. 4), sodass der Durchtrittswiderstand RD bestimmt und daraus die Korrosionsrate berechnet werden kann. Dazu wird der Polarisationswiderstand ΔU/ΔI [5] mit RD gleichgesetzt:
<2>
Dabei sind ikorr die Korrosionsstromdichte (Bezugsfläche A), R die allgemeine Gaskonstante, T die absolute Temperatur, α der Durchtrittsfaktor der Reaktion, z die Anzahl der pro Anodenreaktion ausgetauschten Elektronen, e die Eulersche Zahl und F die Faraday-Konstante. Bei Säurekorrosion von Eisen (z = 2, T = 298 K) bei A = 0,785 cm2 folgt daraus für ikorr:
<3>
und für die Korrosionsrate kkorr unter Nutzung der Dichte von Eisen (7,874 g/cm3) bei α = 0,5:
<4>
Zu jedem Zeitpunkt kann der Wert von RD aus den simulierten Spektren extrahiert werden.
Die Zeitverläufe der Durchtrittswiderstände und der Korrosionsraten sind in Abbildung 5 dargestellt.
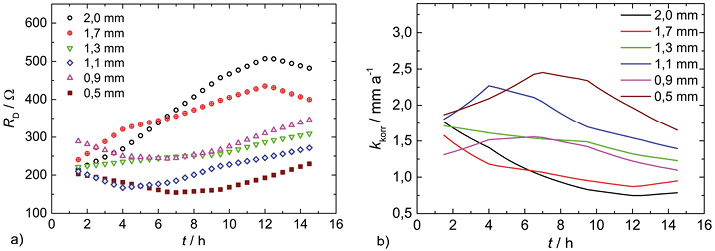
Abb. 5: Zeitverläufe von RD (a) und kkorr (b) verschiedener DC04-Bleche bei der Korrosion in Schwefelsäure (pH 1,8)
Die Korrosionsraten zeigen zu Beginn der Messungen vergleichsweise hohe Werte. Bei den beiden Blechen mit größter Dicke (geringstem Umformgrad) verringern sie sich im Zeitverlauf. Für die dünneren Bleche ist ein Maximum erkennbar, dass sich mit abnehmender Blechdicke zu höheren Korrosionszeiten hin verschiebt. Dies kann Hinweise auf Tiefengradienten der mikrostrukturellen Größen geben, die die Korrosion beeinflussen.
Durch Integration der berechneten Korrosionsraten über die Versuchsdauer (Abb. 5) kann der integrale Masseverlust eines Blechs berechnet werden. Dieser wurde zur Verifizierung der berechneten Werte zusätzlich durch Wiegen der Bleche vor und nach den Messungen bestimmt. Tabelle 1 zeigt die berechneten und gemessenen Masseverluste im Vergleich.

Die Abweichung zwischen den beiden Verfahren liegt unter 15 % und durchschnittlich unter 10 %. Da am Probenträger Spaltkorrosion unter dem Dichtring auftrat, die sich auf den Masseverlust, aber nur unwesentlich auf die EIS-Messungen auswirkt, liegen die mit EIS gemessenen Werte systematisch etwas niedriger und weisen eine höhere Genauigkeit auf.
Die aufgezeigte Methode zur Quantifizierung der Korrosionsrate mittels EIS stellt ein wichtiges Werkzeug dar, das Kurzzeitkorrosionsverhalten zu charakterisieren. Dies ermöglicht beispielsweise die Untersuchung der Wirksamkeit von temporären Korrosionsschutzmaßnahmen, sodass die Schutzdauer und räumliche Homogenität des Schutzes bei Kontakt mit flüssigen Medien bestimmt werden kann. Speziell kleine Korrosionsraten sind zugänglich, deren Bestimmung über den Masseverlust zu großen Messunsicherheiten führen würde. Es ist außerdem prinzipiell möglich, die Korrosionsrate ohne Ausbauen eines Bauteils und an schwer zugänglichen Orten in situ zu messen.
Danksagung
Der Dank der Autoren gilt der Deutschen Forschungsgemeinschaft (DFG) für die Förderung der Arbeiten im Rahmen des Forschungsprojekts LA1274/27-1.
Literatur
[1] Dechema: Pressemitteilung zum Weltkorrosionstag 2011; http://dechema.de/19_2011+
Weltkorrosionstag+2011-p-123972.html, aufgerufen am 11.02.2017
[2] M. Stern, A. L. Geary: Electrochemical Polarization: I. A Theoretical Analysis of the Shape of Polarization Curves; Journal of The Electrochemical Society 104 (1957), S. 56–63
[3] J. R. Macdonald: Impedance spectroscopy; Annals of Biomedical Engineering 20 (1992), S. 289–305
[4] F. Frenzel: Über das korrosive Verhalten von Eisen in Essigsäure; Materials and Corrosion 27 (1976),
S. 20–24
[5] M. Stern: A Method For Determining Corrosion Rates From Linear Polarization Data; Corrosion 14 (1958), S. 60–64
DOI: 10.7395/2017/Scharf7
Kontakt:
Univ.-Prof. Dr.-Ing. habil. Thomas Lampke; Technische Universität Chemnitz, Professur Werkstoff- und Oberflächentechnik, D-09107 Chemnitz
Dr.-Ing. Thomas Mehner; E-Mail: thomas.mehner@mb.tu-chemnitz.de
- www.tu-chemnitz.de/mb/WOT






