Von Dipl. Werkstoff-Ing. ETH Dr. Vinzenz Bissig, Thun
Zink ist als Beschichtung auf Stahl eines der wirksamsten Elemente, um Korrosion von Stahl zu vermeiden beziehungsweise stark zu reduzieren. Die Thermodiffusion ist eines von mehreren Verfahren, eine Zinkbeschichtung auf Stahl zu erzeugen. Bei dieser Technologie entsteht eine zinkreiche Gasphase. Die Reaktion von Zink und Eisen führt zur Bildung von intermetallischen Phasen die den Zinkdampf binden. Die Phasen zeigen eine hohe mechanische Beständigkeit und bieten den Vorteil sich gut mit dem Stahlsubstrat zu binden. Auch Kupfer und Kupferlegierungen lassen sich unter Einsatz von Zink mittels Thermodiffusion beschichten, wobei unterschiedliche Kupfer-Zink-Legierungen entstehen
Function of Zinc as Passiv Coating and Cathodic Protection Against Corrosion
The combination of passive coating and cathodic protection is the reason why zinc is one of the most popular corrosion protection systems for steel structures. Thermodiffusion is one way to achieve a zinc coating. There the quite high vapour pressure of the zinc is used to coated samples. But why should the zinc condensate preferable on the steel surface and not e.g. on the zinc itself? The literature shows that Fe-Zn Phases exhibit a lower zinc vapour pressure than from the ideal mixture expected this means that there is an attraction between zinc and iron atoms resulting in a zinc vapour sink. The high zinc containing Fe-Zn like the pure zinc phase is a less good zinc vapour sink, so they are not formed in the Thermodiffusion. Similar observation where found in the Cu-Zn system.
Die jährlichen globalen Folgekosten von Korrosion werden gemäß der 2016-er Studie International Measures of Prevention, Application and Economics of Corrosion Technology (IMPACT) der NACE International - The Worldwide Corrosion Authority auf etwa 2,5 Billionen US-Dollar geschätzt. Zusammen mit dem Verschleiß verursacht Korrosion den höchsten Materialverlust in unserer modernen Welt. Seit der industriellen Revolution ist Eisen/Stahl der wichtigste und der am weitesten verbreitete metallische Werkstoff. Er verfügt über viele vorteilhafte (mechanische) Eigenschaften, bringt aber einen entscheidenden Nachteil mit sich: eine ungenügende Korrosionsbeständigkeit bei üblichen Umgebungsbedingungen. Zwar weisen rostfreie Stähle meist eine ausreichende Korrosionsfestigkeit auf. Sie konnten sich aber aus wirtschaftlichen Gründen und teils wegen ihrer mechanischen/physikalischen Eigenschaften nicht durchsetzen. In diesem Beitrag wird die Zinkthermodiffusion als effizienter Korrosionsschutz von Eisen/Stahl vorgestellt.
1 Korrosionsschutzstrategien
Beim Korrosionsschutz sind zwei Hauptstrategien bekannt: der passive und der kathodische Korrosionsschutz.
Der passive Korrosionsschutz umfasst alle Maßnahmen, die eine abschirmende Wirkung erzielen, typischerweise als Überzug oder Beschichtung. Allgemein unterscheiden sich metallische Werkstoffe von organisch basierten Beschichtungen durch eine höhere Beständigkeit gegenüber UV-Strahlung und eine geringere Durchlässigkeit gegenüber Sauerstoff oder anderen korrosiven Substanzen.
Der kathodische Korrosionsschutz schützt das Material, indem er die zwei Teilreaktionen der Korrosion, die Oxidation (Anode) und Reduktion (Kathode) räumlich trennt (Abb. 1). Bei der richtigen Materialwahl für die Anode findet auf dem Stahl nur die Reduktion von Luftsauerstoff statt und es wird kein Materialabtrag, sprich Korrosion, beobachtet. Die kathodische Teilreaktion erhöht lokal den pH-Wert, was wiederum die Korrosionsgefahr auf dem Stahl reduziert. Dabei hängt die Reichweite des kathodischen Schutzes von der elektrischen Leitfähigkeit der Umgebung ab.
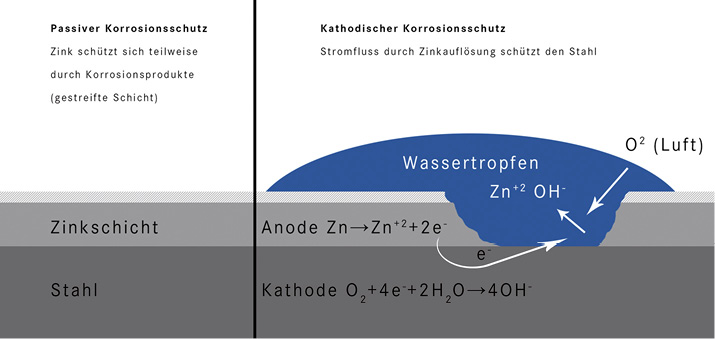
Abb. 1: Zink schützt Stahl beim passiven Korrosionsschutz durch die geschlossene Zinkschicht, teilweise durch Korrosionsprodukte (links); beim kathodischen Korrosionsschutz wirkt Zink als Opferanode (rechts), wobei auf Zink die anodische Teilreaktion (Metallauflösung/ Oxidation) und auf Stahl/Eisen die kathodische Teilreaktion (Sauerstoffreduktion) stattfindet
Ein Überzug aus unedlen Elementen kann beide Korrosionsschutzfunktionen gleichzeitig erfüllen: Ein fehlerfreier Überzug schützt den Stahl passiv. Bei Fehlstellen (z B. Kratzern) kann der Überzug mit dem kathodischen Korrosionsschutz den Stahl weiter vor Korrosion schützen. Sobald aber sämtliche metallische Anteile des Überzugs verbraucht sind, beginnt die Korrosion des Eisens.
Für die Kombination von kathodischem und passivem Korrosionsschutz wirken verschiedene Elemente in unterschiedlicher Art:
- Alkalimetalle (Na, K, Li…) und Erdalkalimetalle (Ca, Ba usw.) sind zu unedel und zu reaktiv mit wässrigen Lösungen. Infolge der Reaktivität kommen diese Elemente als passiver Korrosionsschutz nicht infrage, zumal sie auch zu reaktiv für den kathodischen Schutz sind.
- Eine Ausnahme stellt das Element Magnesium dar, das deutlich weniger reaktiv ist, als andere Alkali- und Erdalkalielemente. Magnesium wird oft als Opferanode zum Beispiel für Schiffe oder andere Großkonstruktionen verwendet. Allerdings ist Magnesium so unedel, dass auch leicht Wasserstoff entstehen kann. Daher ist Magnesium gerade als Überzug für hochfeste Stähle nicht zu empfehlen.
- Titan und Chrom sind hervorragend geeignet als passiver Korrosionsschutz (z. B. verchromte Oberflächen). Beide Elemente haben aber die Tendenz, sehr leicht zu passivieren. Sie würden sich im kathodischen Korrosionsschutz falsch polen und so die Korrosion sogar fördern.
- Aluminium ist in neutralen und salzarmen Lösungen passiv und weist unter diesen Bedingungen keinen kathodischen Korrosionsschutzmechanismus auf.
- Zink ist genug unedel und immer genug aktiv für den kathodischen Schutz (Tab. 1). Zudem zeigt das Element erstaunlich geringe Korrosionsgeschwindigkeiten, da diverse Korrosionsprodukte den Zugang von frischem Sauerstoff und/oder Wasser teils blockieren, aber nicht ganz passivieren. Darum ist Zink auch als passiver Korrosionsschutz geeignet (Tab. 1).
Zink als Kombination von kathodischem und passivem Korrosionsschutz erfüllt auch die kostenseitigen industriellen Anforderungen und ist gesundheitlich sowie unter Arbeitssicherheitsaspekten unbedenklich.

Ein weiterer Grund, weshalb Zink im Korrosionsschutz so verbreitet ist: Es gibt vielfältige Möglichkeiten, Zink zu applizieren. Es kann elektrolytisch, mechanisch, aus der Schmelze oder aus der Gasphase abgeschieden werden. Aluminium lässt sich aus wässrigen Lösungen nicht elektrolytisch abscheiden. Alle Verzinkungsprozesse haben ihre speziellen Eigenschaften und Temperaturbereiche. Deshalb kann für jedes Produkt der richtige Prozess gewählt werden, um einen optimalen Korrosionsschutz zu erreichen.
2 Zinkthermodiffusionsprozess: Verzinken mit der Gasphase
Alle Beobachtungen weisen darauf hin, dass beim Thermodiffusionsprozess (TD) Zink über die Gasphase transportiert wird. Dabei wird der erstaunlich hohe Dampfdruck des Elements Zink bereits im festen Zustand ausgenutzt. Abbildung 2 zeigt den Dampfdruck von Zink als Funktion der Temperatur. Die Kurve lässt sich wie folgt beschreiben: Zwischen 300 °C und 400 °C verdoppelt sich der Dampfdruck etwa alle 20 °C und erreicht bei 400 °C etwa 10 Pa oder 1/10 000 Bar.

Abb. 2: Zinkdampfdruck [2]

Abb. 3: Eindringen des Zink/Zinkdampfs in den Spalt eines Bauteils; damit ist eine Zinkbeschichtung auch in normalerweise schwierig zu erreichenden Spalten und Löchern möglich
Solange eine ausreichende Menge an Zink vorhanden ist, ist der Zinkdampfdruck unabhängig von der Zinkmenge und nur eine Funktion der Temperatur. Sauerstoff oder andere reaktive Gase reagieren mit dem dampfförmigen Zink zum Beispiel zu Oxiden, welche bei den Temperaturen nicht flüchtig sind. Die Verfügbarkeit von Zink im Prozess würde so beispielsweise durch Luft reduziert werden. Darum wird der Thermodiffusionsprozess in einem abgeschlossenen Volumen, üblicherweise in einem Container, durchgeführt. Zink in der Dampfphase hat folgende Vorteile:
- Es wird eine hundertfach höhere Beweglichkeit der Atome (Selbstdiffusionskoeffizient) als in der flüssigen Phase (Schmelze) beobachtet
- Dampfphasen zeigen immer eine perfekte Benetzung und erfordern kein Flussmittel wie bei Prozessen mit flüssigen Phasen
- Es gibt keine Grenzflächen/Oberflächenkräfte, die ein Ablaufen/Auslaufen einer flüssigen Phase erschweren können
- Es muss kein elektrisches Feld aufgebaut werden, wodurch es kaum Einschränkungen durch die Geometrie gibt und es der Technologie ermöglichen, gleichmäßige Zinkschichten in sonst schwierig zu erreichenden Spalten (Abb. 3) und/oder Sacklöchern zu gewährleisten
3 Triebkraft hinter dem Zinkthermodiffusionsprozess
Zunächst stellt sich bei der Betrachtung der Details des Verfahrens der Zinkthermodiffusion die Frage, weshalb sich Zink ausgerechnet auf dem Stahlbauteil niederschlägt. Das Zink könnte auch bevorzugt auf der Containerwand oder wieder auf dem Zinkpartikel abgeschieden werden. Im Folgenden wird dargelegt, worauf die Triebkraft hinter dem Zinkthermodiffusionsprozess beruht.
Kazuaki et al. [3] haben mittels Massenspektrometrie den Dampfdruck von Zink von vier verschiedenen Eisen-Zink-Legierungen (67,1 % bis 92 % Zink) bei vier unterschiedlichen Temperaturen (350 °C, 375 °C, 400 °C, 425 °C) gemessen. Dargestellt wird der Dampfdruck als Aktivität, die zwischen 0 und 1 variieren kann. Aktivität 0 entspricht keinem messbaren Zinkdampfdruck und 1 dem Dampfdruck von reinem, unlegiertem Zink. Die erwartete Aktivität eines Elements in einer idealen Mischung ist gleich dem Atomanteil des Elements in der Legierung. In Abbildung 4a ist der Verlauf der gemessenen Aktivität dargestellt. Die Werte liegen deutlich unter der Erwartung an eine ideale Mischung. Die eingezeichneten roten Bereiche zeigen die Stabilitätsgrenzen der einzelnen intermetallischen Phasen, welche in Abbildung 4b dargestellt sind.
 |
 |
| Abb. 4a: Aktivität von Zink bei 350 °C [3]; die blaue Linie entspricht der Aktivität der idealen Mischung | Abb. 4b: Ausschnitt der zinkreichen Ecke [4] des Phasendiagramms für Zink-Eisen; die rote Linie entspricht den 350 °C in Abbildung 4a |
Hoch eisenhaltige, intermetallische Eisen-Zink-Verbindungen senken den Dampfdruck von Zink, weil zwischen den Eisen- und den Zinkatomen eine Anziehungskraft wirkt. Die Anziehung (sprich geringere Aktivität) nimmt aber mit höherem Zinkgehalt stetig ab und bei Erreichen der ζ-Phase liegt die Aktivität fast beim Wert der idealen Mischung. Die Situation im Container lässt sich wie folgt vorstellen: Der Zinkdampf scheidet sich zwar überall ab, aber bei Eisen/Stahloberflächen wird das Zink in Kristallphasen eingebunden, die selbst eine geringe Tendenz zur Zinksublimation aufweisen. Dabei bilden sich eher die Г-, Г1- und δ-Phasen. Die Triebkraft für die Bildung von hoch zinkhaltigem ζ-Phase und reinem Zink der η-Phase ist eher geringer.
Das lässt sich mit der Absorption von Wasserdampf in Kieselgel vergleichen: Der Wasserdampf wird gebunden und kann nicht mehr verdunsten. Dadurch nimmt die Luftfeuchtigkeit um das Kieselgel ab.
Als Gegenbeispiel kann das System Blei-Zink genannt werden. Darin ist die Aktivität immer deutlich höher als vom Legierungsanteil zu erwarten wäre (Abb. 5).
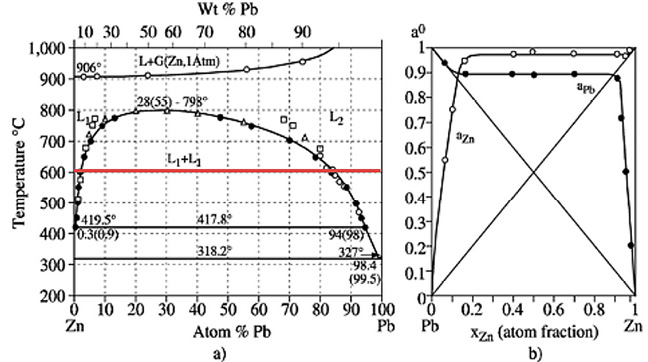
Abb. 5: Phasendiagramm Blei-Zink (links) und Aktivität der beiden Elemente bei 600 °C (rechts) [5]
Die Verwendung von Blei für die Thermodiffusionstechnologie wäre schwierig, weil das Zink ab einem Gehalt von etwa 20 % den Dampfdruck einer idealen Zinklegierung mit 95 % Zinkanteil erreicht hat. Die geringe Anziehung von Blei und Zink wird auch im Phasendiagramm gut sichtbar. Es ist weder eine Mischkristallbildung zu erkennen, noch existieren intermetallische Phasen. Selbst in der Schmelze sind beide Elemente nicht mischbar.
4 Interdiffusion zwischen Stahl/Eisen und Zink
Im Laufe des Thermodiffusionsprozesses kommt es zu einer Interdiffusion von Zink und Eisen, die zur Bildung von intermetallischen Phasen führt. Das Eisen-Zink-Phasendiagramm (Abb. 6) stellt die Abfolge der Phasen und die Zusammensetzungsbereiche dar. Allerdings zeigen Phasendiagramme das thermodynamische Gleichgewicht, also in welche Richtung sich das System entwickeln wird; sie liefern jedoch keine Aussage über die Kinetik (Schnelligkeit) des Vorgangs. In diesem Zusammenhang ist darauf hinzuweisen, dass das Eisen-Zink-Phasendiagramm in verschiedenen Versionen vorliegt, in denen sich die Bezeichnungen der einzelnen Phasen von Autor zu Autor unterscheiden. Für diese Publikation wurde die neueste Version des Eisen-Zink-Phasendiagramms [4] gewählt. Das Eisen-Zink-Phasendiagramm zeigt die Abfolge der intermetallischen Phasen ausgehend vom Stahl/Eisen in Richtung Oberfläche: a (Ferrit-Mischkristall des Stahls/Eisens), Г, Г1, δ, ζ, η (Zink-Mischkristall), gültig zwischen 300 °C und 400 °C.
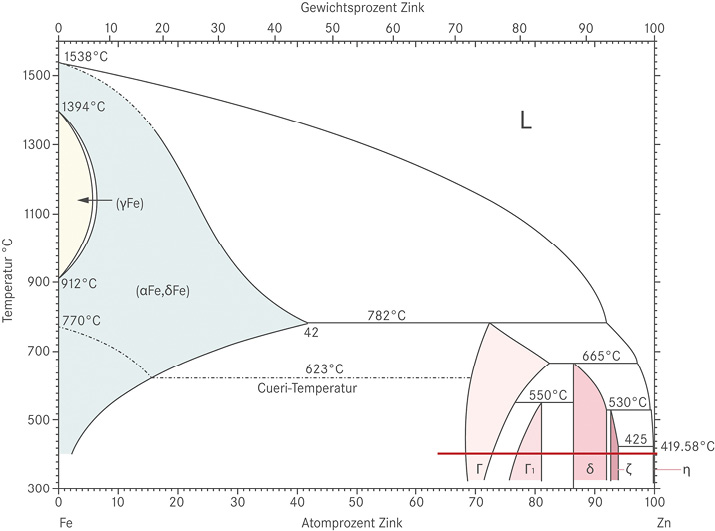
Abb. 6: Eisen-Zink-Phasendiagramm [4]; die rote Linie entspricht 400 °C

Abb. 7: Line Scan einer Zinkschicht mit 20 keV Beschleunigungsspannung; die schwarzen Linien zeigen die als konstante Zusammensetzung interpretierten Bereiche. Bei einem Anteil von 10 % Eisen liegt die Zusammensetzung der δ-Phase vor und bei 20 % bis 25 % Eisen die Г1- beziehungsweise Г-Phase
Mithilfe des Line Scans der REM-Analyse (Abb. 7) kann die lokale Zusammensetzung des Schichtaufbaus analysiert werden. Dabei zeigt sich, dass der große Teil der Schicht aus Zink mit 10 % Eisen besteht. Nahe des Stahls steigt der Eisengehalt auf etwa 20 % bis 25 % an. Danach folgt der abrupte Übergang zum Stahl mit Zink nur noch in Spuren. Werden diese Daten mit dem Phasendiagramm verglichen, entspricht 10 % Eisen der σ-Phase, der Bereiche mit 20 % bis 25 % Eisen der Г1- beziehungsweise Г-Phase. Ein sehr geringer Anteil an Zink wird auch im angrenzenden Stahl als a-Mischkristall gefunden. Bereiche mit einer Zusammensetzung unter 10 % Eisen in der Nähe der ζ- und η-Phase werden im Line Scan bei der REM-Untersuchung nicht detektiert. Eine mögliche Erklärung ist die in Abbildung 4a gezeigte hohe Aktivität (hoher Dampfdruck) dieser Phasen und eine geringe Triebkraft zur deren Bildung aus dem Zinkdampf.
Beim Thermodiffusionsprozess dringt Zink kaum in den Stahl ein, obwohl das Konzentrationsgefälle von der Grenzschicht aus ins Innere des Stahls groß ist. Die Diffusionskoeffizienten bestätigen diese Beobachtung (Tab. 2).

Die Differenz der Diffusionskoeffizienten kann zum großen Teil durch die Unterschiede der homologen Temperatur erklärt werden. Bei der homologen Temperatur handelt es sich um die relative Temperatur eines Materials, wobei 0 % dem absoluten Nullpunkt und 100 % der Schmelztemperatur entspricht. Thermisch aktivierte Prozesse wie die Diffusion nehmen mit einer steigenden homologen Temperatur stark zu. Das erklärt den großen Unterschied von 12 Zehnerpotenzen. Infolge des sehr niedrigen Diffusionskoeffizienten kann die Volumendiffusion von Zink in Stahl/Eisen in einer ersten Annäherung vernachlässig werden.
5 Schichtaufbau auf Kupfer
Eine weitere Legierungsgruppe, die mithilfe der Zink-Thermodiffusion vor Korrosion geschützt werden kann, sind Kupferbasis-Legierungen wie rein Kupfer, Messing oder beispielsweise Rotguss. Einen typischen Schliff durch eine Thermodiffusionsschicht auf Kupfer zeigt Abbildung 8a. Die zu erkennende Abfolge der Farben ist ein starker Hinweis auf verschiedene intermetallische Kupfer-Zink-Phasen (Abb. 8b) oder, anders ausgedrückt, eine Abfolge von Messinglegierungen unterschiedlicher Zusammensetzung.

Abb. 8a: Schliffbild durch eineThermodiffusionsschicht auf Kupfer
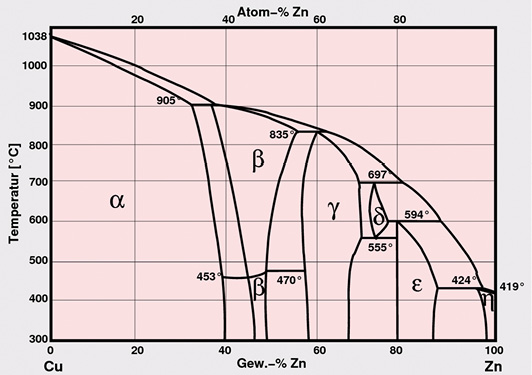
Abb. 8b: Kupfer-Zink-Phasendiagramm [8]

Abb. 9: GDOES-Messung eines Diffusionsexperiments zwischen Kupfer und Zink [9] nach 25 h bei 380 °C
Die GDOES-Messung (Abb. 9) von Hoxha [9] zeigt die Abfolge der intermetallischen Kupfer-Zink-Phasen. Nach der Reinkupferphase (α-Phase) wird eine sehr dünne β-Phase gefunden, gefolgt von der γ- und ε-Phase. Die Messung zeigt auch eine rein Zinkphase (η-Phase), da es sich um ein gefügtes Diffusionspaar handelt.
Mit dieser Information können nun die Phasen im Schliffbild identifiziert werden: Auf das kupferrot Kupfer (α-Phase) folgt zuerst eine sehr dünne hellgelbe (β-Phase), dann eine dunkelgelbe (γ-Phase) und schließlich eine dicke graue Schicht (ε-Phase). Das reine Zink (η-Phase) wird wie beim Stahl nicht gefunden. Die δ-Phase ist nur bei hoher Temperatur stabil und wird darum nicht detektiert. Die ε-Phase fällt beim Thermodiffusionsprozess größer aus, als die γ-Phase, also genau umgekehrt wie bei der hier genannten GDOES-Messung. Dies könnte ein Hinweis darauf sein, dass die Diffusion und Reaktionsgeschwindigkeit von Kupfer mit Zinkdampf anders ist, als Kupfer mit metallischem Zink.
6 Einzigartiger Korrosionsschutz mittels Thermodiffusion
Das Element Zink kombiniert die richtigen Eigenschaften für den Korrosionsschutz durch Passivierung und für den kathodischen Korrosionsschutz: Zink ist elektrochemisch ausreichend unedel für den kathodischen Korrosionsschutz, aber nicht so unedel, dass wie bei Magnesium Wasserstoff entstehen könnte. Es zeigt eine geringe Korrosionsgeschwindigkeit für den passiven Korrosionsschutz, aber keine Passivität, wie beispielsweise Aluminium. Zudem kann es über verschiedenste Verfahren (elektrolytisch, mechanisch, Dampfphase, Schmelze) auf Bauteile aufgetragen werden und bietet somit für jede Applikation ein geeignetes Verfahren. Zink ist kostengünstig, weltweit verfügbar und gesundheitlich sowie unter Arbeitssicherheitsaspekten unbedenklich.
Der Thermodiffusionsprozess verzinkt mittels der Gasphase. So kann die Beschichtung sehr gut in Spalten und Löcher eindringen und es gibt keine Benetzungs- und Auslaufprobleme wie beim Verzinken mit flüssigen Phasen. Durch Thermodiffusion aufgebrachte Zinkschichten haben dank der Diffusionsreaktion optimale Haftung auf den Bauteilen und führen zu einer sehr gleichmäßigen Schicht (Abb. 10).

Abb. 10: Thermodiffusions-Zinkschicht auf einer Schraube
Literatur
[1] Uhlig‘s Corrosion Handbook; 3rd Edition, R. Winston Review (Editor), ISBN: 978-0-470-08032-0, April 2011, Seite 130
[2] Vapor pressures of the elements (data page); 04.07.2017, https://en.wikipedia.org/wiki/Vapor_pressures_of_the_elements_(data_page)
[3] Mita Kazuaki, Yamaguchi Shu, Maeda Masafumi: Vapor Pressure Measurement of Zn-Fe Intermetallic Compounds; Metallurgical And Materials Transactions B; Volume 35b, June 2004—487
[4] http://www.rebresearch.com/blog/much-of-the-chemistry-you-learned-is-wrong/ (abgerufen 28.08.2018)
[5] Alain Vignes: Extractive Metallurgy 1: Basic Thermodynamics and Kinetics; Seite 74
[6] J. S. Dohie, J. R. Cahoon, W. F. Caley: The Grain-Boundary Diffusion of Zn in α-Fe; Journal of Phase Equilibria and Diffusion, Vol. 28, No. 4, 2007
[7] Physical Metallurgy (Fourth Edition); Volume 1, Chapter 7 - Diffusion In Metals And Alloys, Edited by: Robert W. Cahn and Peter Haasen; Seite 578
[8] http://ruby.chemie.uni-freiburg.de/Vorlesung/
intermetallische_4_4.html (abgerufen 28.08.2018)
[9] Adhurim Hoxha, Heinrich Oettel, Dietrich Heger: Calculation of the Interdiffusion Coefficient in the Cu-Zn Diffusion couple; AIP Conference Proceedings 2010, 1203:1, 591–595



