Aktuelles aus der medizintechnischen Forschung und Entwicklung des Fraunhofer IFAM
Degradierbare Implantate stellen eine wichtige Gruppe der Implantate dar, da durch ihren Einsatz eine Belastung des Körpers durch die Operation zur Entfernung des Implantats entfallen kann. Die hier verwendbaren Materialien müssen allerdings für den Körper unkritisch sein und zugleich alle medizinischen Funktionen wie hohe Stabilität und ausreichend lange Lebensdauer erfüllen. In Betracht kommen hierfür Polymere, Keramiken und Magnesium oder Eisen als metallische Werkstoffe. Zur Herstellung von Implantaten bieten sich insbesondere die additiven Fertigungsverfahren mit ihren hohen Freiheitsgraden bezüglich einer individuellen Formgebung an. Darüber hinaus ist durch Zusatzbearbeitung der Oberfläche beispielsweise eine optimierte Funktionalisierung erreichbar, wie zum Beispiel eine Einstellung der Benetzung oder Verbesserung der Anwachsbedingungen an Knochenmaterial.
Degradable Implants – Latest Developments in Medical Research and Development at the Fraunhofer IFAM Institute
Degradable implants constitute a special and important category of such devices which, when used, obviate the additional trauma involved, were the surgical removal of such an implant to be necessary. The materials used in such cases must be tissue-compatible and at the same time, provide the medically-required properties such as high stability and sufficient lifetime before breaking down. Candidate materials include polymers, ceramics and magnesium or iron as metals. Additive manufacturing has shown itself to be ideally suited for the manufacture of such items, given the high degree of freedom with which customised components can be produced. In addition, the subsequent processing of the surface, for example optimised functionalisation can be achieved, for example improved surface wetting or improved osseo-integration.
In einigen medizinischen Teilbereichen, wie der Orthopädie, der Unfallchirurgie oder der MKG-Chirurgie, werden Implantate vielfältig eingesetzt, um geschädigte Knochen zu unterstützen, entfernte Knochen zu ersetzen oder fixierende Funktionen zu übernehmen. Dabei können Implantate grundsätzlich temporär oder permanent eingesetzt werden. Permanentimplantate sind darauf ausgelegt, für die gesamte Restlebensdauer des Menschen im Körper zu verbleiben und ihre jeweilige Funktion zu erfüllen [1]. Dazu zählen beispielsweise Fusioncages zur Stabilisierung der Wirbelsäule oder auch Prothesen. Temporäre Implantate dagegen werden nach einer bestimmten Verweildauer im Körper entfernt oder bauen sich ab. Diese biodegradierbaren Implantate sind in den vergangenen Jahren und Jahrzehnten Gegenstand von zahlreichen Forschungs- und Entwicklungsaktivitäten gewesen und sind es auch heute noch. Dies liegt daran, dass Permanentimplantate, insbesondere solche aus Metall, einige potentielle Nebenwirkungen mit sich bringen, die dem Patienten möglichst erspart bleiben sollen.
Zum Einsatz kommen in der Medizintechnik heutzutage hauptsächlich drei Metalltypen: Edelstahl, Cobalt-Chrom-Legierungen und Titan-Legierungen. Ein Hauptgrund für ihren Einsatz ist in den mechanischen Eigenschaften zu sehen, die sie für hohe und häufig wiederkehrende Belastungen geeignet machen. Die Festigkeiten sind dabei aber gegenüber dem Knochen so viel größer, dass es bei ihrem Einsatz zu einer Kraftabschirmung des Knochens kommt (Stress-shielding), die für den Knochen notwendige Reize vermindern und so zu dessen Abbau führen kann [2]. Auch kann es zu Unverträglichkeiten mit metallischen Implantaten kommen, durch die eine Hypersensibilisierung gegen Metalle entsteht. In diesem Zusammenhang sind insbesondere die chemischen Elemente Nickel, Cobalt und Chrom als kritisch anzusehen.
Neben diesen biologischen Effekten kann eine Implantatermüdung zum Implantatversagen führen. Auch patientenspezifische Umstände können problematisch sein, seien es das Wachstum bei Kindern oder die mit dem Alter geringer werdende Fähigkeit zur Knochenneubildung. In allen Fällen kann die Notwendigkeit zur Entfernung des Implantats die Folge sein. Dies bedeutet für den Patienten eine zusätzliche Operation mit allen ihren Risiken und Folgen und erzeugt Kosten für das Gesundheitssystem. Diese Gründe sind wesentliche Motivatoren für die Forschung und Entwicklung im Bereich der biodegradierbaren Implantate. Die Entwicklung neuer Medizinprodukte ist ein vielschichtiger Prozess, bei dem ausgehend von der medizinischen Anforderung der Werkstoff, die Fertigung und eine mögliche Funktionalisierung betrachtet, aber auch umfangreiche Fragestellungen zur Analytik und zu zulassungsrelevanten Themen einbezogen werden müssen. Im Folgenden werden aktuelle Themen der Forschung und Entwicklung des Fraunhofer Instituts für Fertigungstechnik und Angewandte Materialforschung IFAM aus dem Bereich der Medizintechnik beleuchtet.
1 Werkstoffe
Im Hinblick auf biodegradierbare Implantate finden Materialien aus allen übergeordneten Werkstoffgruppen (Polymer, Metall, Keramik einschließlich Glas), sowie häufig aus deren Kombinationen in Form von Verbundwerkstoffen oder Werkstoffverbunden Anwendung. Bei polymerbasierten biodegradierbaren Werkstoffen werden seit mehreren Jahren verschiedene Polymere eingesetzt, häufig in den Bereichen Tissue Engineering oder Drug Delivery [3].
Für Fixationselemente im Knochen (z. B. Interferenzschrauben) kommen beispielsweise Polymere auf Basis von Polymilchsäure (PLA, polylactic acid) zum Einsatz. Durch die hohe Zähigkeit von Polymeren sind sie gut handhabbar für Chirurgen, durch die relativ geringe Festigkeit hingegen nur für nicht oder nur gering lasttragende Applikationen geeignet. Die Resorbierbarkeit von PLA basiert auf der Hydrolyse, in deren Verlauf Milchsäure gebildet wird. Diese bewirkt eine Absenkung des pH-Werts im Bereich des Implantats, die wiederum Entzündungen oder den Abbau von umliegendem Knochengewebe zur Folge haben kann. Um derartigen Komplikationen vorzubeugen, werden dem Polymer häufig Keramikpartikel aus der Gruppe der Calciumphosphate zugesetzt. Diese bringen nicht nur den Vorteil mit sich, die Absenkung des pH-Werts durch eine Pufferwirkung zu vermindern, sie liefern dem Körper auch gleichzeitig ein Material, das zur Knochenneubildung genutzt werden kann. Die Voraussetzung dafür ist, dass ein Calciumphosphat eingesetzt wird, das eine gewisse Löslichkeit aufweist.
Zudem spielen die am bone remodelling beteiligten knochenabbauenden Zellen, die Osteoklasten, eine wichtige Rolle bei der Resorption [4]. Sie beteiligen sich direkt auch am Abbau der Calciumphosphatphase, allerdings unterschiedlich stark bei unterschiedlichen Typen. So wird beispielsweise Tricalciumphosphat (TCP) deutlich besser abgebaut als Hydroxylapatit (HA). Dies ist im Prinzip wiederum der Löslichkeit, allerdings bei erniedrigtem pH-Wert zuzuschreiben, da die Osteoklasten, die sich auf einem Material ansiedeln, wie eine Glocke ausprägen, innerhalb derer der pH-Wert zur Knochenresorption abgesenkt wird. Die Eigenschaften unterschiedlicher Calciumphosphate sind also bei der Materialauslegung genau zu betrachten.
Am Fraunhofer IFAM liegt der Fokus der Entwicklungen im Bereich der Polymerkomposite auf der Einstellung hoher Füllstoffanteile und der damit verbundenen Anpassung der Verarbeitung der Komposite. In einem etablierten Prozess können beliebig hohe Füllstoffanteile realisiert werden und es stehen verschiedene Fertigungstechnologien zur Formgebung zur Verfügung. Abbildung 1 zeigt Bauteile aus Kompositen aus PLA und Tricalciumphosphat (TCP).

Abb. 1: Kompositbauteile aus PLA-TCP (© Fraunhofer-IFAM)
Der Ersatz von PLA durch TCP hat neben den Vorteilen hinsichtlich der pH-Pufferung und dem Einbringen von Material zum Knochenaufbau auch aus Sicht der Kosten Vorteile, da medizintechnisch zugelassene Polymere erheblich teurer sind als Keramikpulver. Der Prozess ist zudem auf andere Polymere und nahezu beliebige Füllstoffe anwendbar, sodass viele weitere Materialkombinationen möglich sind und damit verschiedenste Anwendungen adressiert werden können.
Im Bereich der Metalle gibt es nur wenige Kandidaten, die sich für degradierbare Implantate eignen. Seit kurzem gibt es das erste zugelassene Implantat auf Basis von Magnesium, auch wenn das Metall schon im späten 19. Jahrhundert medizintechnisch eingesetzt wurde [5]. Beim Magnesium besteht die große Herausforderung darin, eine Legierung zu entwickeln, die eine ausreichend langsame Degradationsgeschwindigkeit aufweist [6].
Eine weitere Möglichkeit liegt in einem sehr hohen Reinheitsgrad, da die schnelle Korrosion beim Magnesium den Verunreinigungen zugeschrieben wird [7]. Bei zu hohen Degradationsraten kann zum einen ein zu schneller Implantatabbau aufgrund einer im gleichen Zeitraum unzureichenden Knochenneubildung problematisch sein. Zum anderen entwickelt sich bei der Korrosion von Magnesium Gas, das bei zu schneller Korrosion in zu großem Maße auftritt und nicht ausreichend schnell vom Körper entfernt werden kann.
Ein anderes vielversprechendes Metall ist in diesem Zusammenhang das Eisen, das im Fokus der Forschungsaktivitäten am Fraunhofer IFAM steht. Die Biokompatibilität von Eisen konnte mittlerweile in Tierstudien nachgewiesen werden [8]. Während allerdings die Korrosion von Magnesium unter Gasentwicklung und relativ schnell verläuft, bildet sich bei der Korrosion von Eisen kein Gas und sie verläuft relativ langsam [9]. Zudem benötigt die Korrosion von Eisen neben Wasser auch die Anwesenheit von Sauerstoff für die kathodische Reaktion. Daher steht bei dem Einsatz von Eisen als degradierbares Implantatmaterial die Beschleunigung der Degradation im Fokus der Forschungs- und Entwicklungsaktivitäten. In einem gemeinsamen Projekt mit den Fraunhofer-Instituten ILT, IGB und IBMT (DegraLast) wurden unter anderem potentiell geeignete Eisenlegierungen beforscht, sowie Komposite auf Basis von Eisen und TCP entwickelt. Der Gedanke dabei war es, dem Körper einen Werkstoff anzubieten, der zum einen dem Knochen die Möglichkeit bietet, einzuwachsen und zum anderen über einen längeren Zeitraum mechanische Stabilität verleiht. Durch die Herstellung eines Durchdringungsverbunds aus Eisen und TCP, also einer Struktur, bei der sich die in sich zusammenhängende Eisenmatrix und die in sich zusammenhängende TCP-Matrix dreidimensional durch das gesamte Implantat durchdringen, sollen diese Eigenschaften erreicht werden [10]. So soll der Körper durch den Abbau von TCP in das Implantat einwachsen und die eisenbasierte Phase nach und nach abgebaut werden. Im Zuge des langsamen Abbaus der metallischen Phase kann neuer Knochen den entstehenden Raum zur Neubildung nutzen.
Abbildung 2 zeigt ein Demonstratorimplantat und eine elektronenmikroskopische Aufnahme der Mikrostruktur des Eisen-TCP-Komposits. Dabei ist die hellere Phase das Eisen und die dunklere Phase das TCP.

Abb. 2: Schulteranker aus Eisen-TCP mit Mikrostruktur (oben rechts) (© Fraunhofer IFAM)
Die optimierte Degradation gegenüber dem reinen Metall durch die Erzeugung eines Komposits mit TCP konnte in vitro nachgewiesen werden [11]. Im Hinblick auf die mechanischen Eigenschaften eignet sich der Werkstoff potentiell für Anwendungen in denen hohe Lasten auf das Implantat einwirken; ein Vorteil den metallbasierte Implantate gegenüber polymerbasierten Implantaten mit sich bringen.
Bei keramischen Werkstoffen können ebenfalls hohe Lasten toleriert werden, allerdings bevorzugt Drucklasten, da die hohe Sprödigkeit der Keramiken zu einer geringen Toleranz gegenüber Zug- und Biegebeanspruchungen führt. Neben den bioinerten Hochleistungskeramiken Aluminiumoxid und Zirkonoxid, die vor allem für Prothesen und im Dentalbereich Einsatz finden, sind Calciumphosphat-Keramiken interessant für die Medizintechnik [12]. Sie verfügen über eine ausgezeichnete Biokompatibilität und sind in den Knochen integrierbar, zum Beispiel im Falle des synthetischen Hydroxylapatits (HA), oder vollständig degradierbar, wie das Beispiel von TCP zeigt.
Da die mechanische Stabilität der Calciumphosphate allerdings eher gering im Vergleich zu den genannten Oxidkeramiken ist, muss dies beim Implantatdesign besonders beachtet werden. Mit diesem Thema beschäftigt sich das Fraunhofer IFAM in einem vom BMBF geförderten Projekt gemeinsam mit den Partnern der Universität Bremen und den Universitätskliniken Gießen und Marburg sowie Bonn (VIP-Vorhaben HA-Schraube). Im Rahmen dieses Vorhabens wurde eine Interferenzschraube hinsichtlich ihres Designs keramikgerecht angepasst und aus Calciumphosphat hergestellt. Abbildung 3 zeigt diese Implantate.

Abb. 3: Schraubnägel aus Calciumphosphat (© Fraunhofer-IFAM)
Im Gegensatz zur klassischen Interferenzschraube wird der neu entwickelte Schraubnagel nicht in den vorgebohrten Knochen geschraubt sondern wie ein Nagel eingehämmert. Durch das spezielle Gewinde wird der Schraubnagel beim Vorschub in Rotation versetzt. Da die Anzahl an Drehungen beim Einbringen des Schraubnagels in den Knochen geringer ist als bei einer Interferenzschraube, und das Gewinde nicht selbstschneidend ist, kann die Gefahr der Verletzung des Transplantats bei der Kreuzbandrekonstruktion gemindert werden. Durch die Wahl von Calciumphosphat als Material wird zudem eine etwaige Implantatentfernung obsolet, da selbst bei einer erneuten Ruptur des Kreuzbandes das Implantat wie eigenes Knochenmaterial herausgebohrt werden könnte, sofern es noch nicht vollständig abgebaut worden wäre.
Im Hinblick auf die mechanischen Eigenschaften ist allerdings auch das Einhämmern des Schraubnagels in eine vorgebohrte Öffnung nicht unkritisch für ein keramisches Bauteil. Daher wurde in der Entwicklung zunächst vom höchstfesten Calciumphosphat, dem Hydroxylapatit, ausgegangen. Dessen Eignung für den chirurgischen Eingriff konnte nachgewiesen werden, sodass im Zuge der weiteren Entwicklungen die Eignung degradierbarer Calciumphosphate untersucht werden konnte. Dabei wurde der Ansatz verfolgt, dem Hydroxylapatit eine gewisse Menge an Siliziumdioxid zuzusetzen, welches im Zuge des Sinterschritts bei der Herstellung die Umwandlung von HA in TCP bewirkt [13]. Trotz der eigentlich deutlich geringeren mechanischen Festigkeit von TCP gegenüber HA konnten Werkstoffe mit vergleichbaren Festigkeiten hergestellt werden. Der Einsatz eines solchen Materials in der medizintechnischen Anwendung ist damit einen großen Schritt näher gerückt.
2 Formgebung
Bei der Entwicklung neuer Werkstoffe muss immer auch der Formgebungsprozess mitbetrachtet werden. Denn nur durch einen optimal angepassten Herstellungsprozess können die bestmöglichen Materialeigenschaften garantiert werden. Zudem stellt sich bei Implantaten die Frage, ob Standardgrößen in hohen Stückzahlen oder individuell angefertigte Einzelstücke eingesetzt werden können oder müssen. Da die meisten Implantate zudem noch relativ komplexe Bauteile darstellen, ist die Wahl des jeweiligen Herstellungsprozesses auf einige wenige Prozesse beschränkt.
Am Fraunhofer IFAM werden vorwiegend pulverbasierte Prozesse eingesetzt, die eine Alternative zu den häufig genutzten zerspanenden Prozessen darstellen. Der Fokus liegt dabei zum einen auf dem Pulverspritzgießen, das sich für kleine, komplexe Bauteile in hohen Stückzahlen eignet, sowie auf additiven Fertigungsverfahren, wie dem Selective Laser Melting (SLM), dem Electron Beam Melting (EBM) oder dem Binder Jetting. Dem Pulverspritzgießen liegt das klassische Kunststoffspritzgießen zu Grunde, weshalb die eingesetzten Anlagen auch zur Verarbeitung polymerbasierter Werkstoffe eingesetzt werden. Beim Pulverspritzgießen schließen sich nach der Formgebung noch die Prozessschritte der Entbinderung und Sinterung an, um so zu dichten Bauteilen zu gelangen. Die additiven Fertigungsverfahren sind eher für individuelle Bauteile und Klein- beziehungsweise Vorserien einsetzbar.
Die genannten Verfahren bieten zudem weitere für die Medizintechnik nützliche Möglichkeiten. So lassen sich über das Pulverspritzgießen auch poröse Bauteile über das Platzhalterverfahren herstellen. Dabei kann das gesamte Bauteil oder auch nur ein gewisser Teil mit definierter Porosität versehen werden. Für Knochenimplantate kann somit das Einwachsen von Knochen in das Implantat zusätzlich angeregt werden.
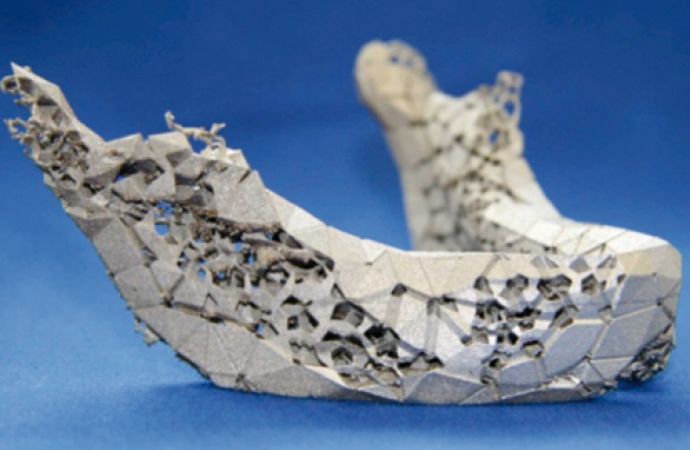
Die additiven Verfahren bieten die besondere Möglichkeit, topologieoptimierte Strukturen herzustellen. Ein Beispiel dafür ist in Abbildung 4 zu sehen. Damit können Implantate auf die genauen Anforderungen des Patienten ausgelegt und fertigungstechnisch umgesetzt werden.

Abb. 4: Studie eines topologieoptimierten Unterkiefer-Implantats (© Fraunhofer-IFAM)
Auch der Einsatz von degradierbaren Werkstoffen ist über additive Fertigungsverfahren möglich. Die Kombination von patientenspezifischer Geometrie mit der Abstimmung von Materialeigenschaften auf die persönliche Situation des Patienten (z. B. Alter oder gesundheitliche Faktoren) ist ein vielversprechendes Thema für zukünftige Entwicklungen.
Neben dem Material und der Implantatgeometrie spielt die Oberflächenbeschaffenheit eines Implantats eine entscheidende Rolle für seinen erfolgreichen Einsatz, da die direkte Wechselwirkung mit dem Körper an der Oberfläche stattfindet. In diesem Zusammenhang wird am Fraunhofer IFAM auch intensiv an der Funktionalisierung von Oberflächen geforscht.
3 Funktionalisierung
Eine Funktionalisierung von Bauteilen kann zum einen direkt im Rahmen der Fertigung des Bauteils, zum anderen in einem nachgelagerten Prozess erfolgen. Bei der Formgebung können Oberflächenstrukturen lokal oder flächig auf Bauteile aufgebracht werden. Dadurch lassen sich beispielsweise die Verankerung im Knochen verbessern oder das Anwachsverhalten von Zellen beeinflussen.
Als nachgelagerte Prozesse in der Fertigung werden Oberflächenmodifizierungen und Beschichtungen zur Funktionalisierung eingesetzt. Dadurch werden entweder die Materialeigenschaften gezielt verändert oder zusätzliche Materialien in das Bauteil integriert, die bestimmte Funktionen ermöglichen.
Neben der direkten Behandlung der Oberfläche, beispielsweise zur Reinigung oder der Änderung der Hydrophilie beziehungsweise Hydrophobie, stehen Beschichtungsprozesse am Fraunhofer IFAM im Fokus der medizintechnischen Forschung und Entwicklung. Ein Beispiel zur Herstellung funktioneller Beschichtungen kommt aus der Plasmatechnik, mit deren Hilfe sowohl zahlreiche technisch relevante Oberflächeneigenschaften als auch antimikrobielle Oberflächen auf medizinischen Komponenten realisiert werden können (Abb. 5).
Neben den technischen Aspekten einer Implantatentwicklung, wie Implantatdesign, Werkstoffwahl, Fertigung und Funktionalisierung, sind zulassungsrelevante Fragestellungen ein wichtiger Bestandteil im Vorfeld einer Produkteinführung.

Abb. 5: Katheter mit antimikrobieller Wirkung durch Plasmatechnik (© Fraunhofer-IFAM)
4 Analytik und Zulassung
Besonders in der Medizintechnik müssen Materialien im Hinblick auf das Einsatzgebiet eine große Zahl von Anforderungen erfüllen. Reinigungsmöglichkeit, Haltbarkeit und mechanische Eigenschaften unterliegen strengen Qualitätsanforderungen, die es zu erfüllen gilt. Hohe Ansprüche an Langzeitstabilität und Zuverlässigkeit der Produkte, starke Normierung und Standardisierung, Zulassungsbeschränkungen und Kostendruck kommen hinzu. Das Bewusstsein um diese Faktoren und eine umfangreiche qualitätsgesicherte Analytik werden am Fraunhofer IFAM in die Produktentwicklungen integriert.
Literatur
[1] E. Wintermantel, S.-W. Ha: Medizintechnik; Springer-Verlag, Berlin, Heidelberg, 2009
[2] R. Gradinger, H. Gollwitzer: Ossäre Integration; Springer Medizin Verlag Heidelberg, 1. Auflage, 2006
[3] B. D. Ulery, L. S. Nair, C. T. Laurencin; Journal of Polymer Science Part B: Polymer Physics (2011) 49, 832–864
[4] R. Detsch, H. Mayr, G. Ziegler; Acta Biomaterialia (2008) Volume 4, Issue 1, 139–148
[5] F. Witte; Acta Biomaterialia (2010) Volume 6, Issue 5, 1680–1692
[6] F. Witte, V. Kaese, H. Haferkamp, E. Switzer, A. Meyer-Lindenberg, C. J. Wirth, H. Windhagen; Biomaterials (2005) Volume 26, Issue 17, 3557–3563
[7] J. Hofstetter, E. Martinelli, A. M. Weinberg, M. Becker, B. Mingler, P. J. Uggowitzer, J. F. Löffler; Corrosion Science (2015) Volume 91, 29–36
[8] T. Kraus, F. Moszner, S. Fischerauer, M. Fiedler, E. Martinelli, J. Eichler, F. Witte, E. Willbold, M. Schinhammer, M. Meischel, P. J. Uggowitzer, J. F. Löffler, A. Weinberg; Acta Biomaterialia (2014) Volume 10, Issue 7, 3346–3353
[9] Y. F. Zheng, X. N. Gu, F. Witte; Materials Science and Engineering: R: Reports (2014) Volume 77, 1–34
[10] S. B. Hein; Powder Metallurgy (2014) Volume 57, Issue 5, 348–356
[11] A. Reindl, R. Borowsky, S. B. Hein, J. Geis-Gerstorfer, Ph. Imgrund, F. Petzoldt; Journal of Materials Science (2014) Volume 49, Issue 24, 8234–8243
[12] J. Chevalier, L. Gremillard; Journal of the European Ceramic Society (2009) Volume 29, Issue 7, 1245–1255
[13] S. Blindow, M. Pulkin, D. Koch, G. Grathwohl, K. Rezwan; Advanced Engineering Materials (2009) Volume 11, Issue 11, 875–884