Von grundlegenden Ideen zu neuen Ansätzen
Mikrobielle Biofilme auf Oberflächen können zu ästhetischen, technischen und hygienischen Problemen führen. Besonders in hygienisch sensiblen Bereichen sollten sie daher konsequent entfernt und ihrer Neubildung vorgebeugt werden. Leitende Oberflächen bieten viele Möglichkeiten, mithilfe sehr geringer Spannungen und Ströme, die auf ihnen angesiedelten Biofilme effizient zu zerstören. Neben einer einfachen elektrostatischen Abstoßung von Bakterien durch eine zumeist negative Aufladung der Oberfläche kommen dabei vor allem elektrochemische Verfahren zum Einsatz, die zum Beispiel durch direkte Oxidation oder durch eine lokale und idealerweise temporäre Erzeugung aggressiver Molekülspezies Bakterien effektiv abtöten. Am bekanntesten ist dabei sicherlich die anodische Oxidation von chloridhaltigen Lösungen an der Oberfläche, die zur Bildung von Chlor und Hypochlorit führt. Hypochlorit ist auch in Chlorbleichen enthalten und wirkt besonders bakterizid. Da anodische Reaktionen und die Bildung von aggressiven, reaktiven Chlorverbindungen jedoch häufig zu Schäden (Korrosion) der betroffenen Oberfläche führen und zudem eine Belastung für Anwender und Umwelt darstellen, werden gegenwärtig vermehrt auch kathodische Verfahren untersucht. Durch die Wahl geeigneter Oberflächen können dabei durch kathodische Reduktion von Sauerstoff in wässriger Lösung mikrobielle Biofilme und andere Ablagerungen sowohl physikalisch, durch entstehendes Wasserstoffgas, als auch chemisch, über reaktive Sauerstoffspezies, die durch die Reduktion von Sauerstoff in der Lösung erzeugt werden, effektiv zerstört werden.
Electrochemical decontamination of conductive surfaces: from basics to new approaches
Formation of microbial biofilms on surfaces can cause aesthetic, technical and hygienic problems. Hence, biofilm prevention and removal is crucial in areas where hygiene is of high importance. Conductive surfaces offer several possibilities for effective biofilm removal and prevention by using low voltages and currents. Besides a simple electrostatic repulsion of bacteria from negatively charged surfaces, other methods are under investigation that are based, for instance, on a direct oxidation or on a local and transient formation of highly reactive molecules that can effectively kill microorganisms. The anodic, surface-based oxidation of chloride-containing solutions yielding chlorine and hypochlorite is a very well established technique. Hypochlorite is a well-known antimicrobial agent that is also contained in bleach. The anodic formation of aggressive and reactive chlorine species, however, can cause corrosive damage of the underlying surface and may be harmful to users and the environment. Consequently, cathodic methods are becoming more widely studied. Using suitable surfaces, cathodic reduction of oxygen in aqueous solutions can remove biofilms physically, i.e. by blowing them off via the formation of hydrogen gas, or chemically, i.e. via the formation of reactive oxygen species.
1 Die Biofilmproblematik
Biofilme sind einfach bis sehr divers zusammengesetzte mikrobielle Gemeinschaften, die auf einer Oberfläche eingebettet in eine Matrix aus extrazellulären polymeren Substanzen (EPS-Matrix) wachsen [1, 2]. Im Vergleich zur planktonischen Lebensform zeigen Mikroorganismen eines Biofilms eine deutlich verringerte Empfindlichkeit gegenüber handelsüblichen Desinfektions- und Reinigungsmitteln sowie gegen Antibiotika. Diese Resistenz beruht unter anderem auf der EPS-Schicht, welche die Zellen wie ein Schutzmantel umgibt. Gleichzeitig zeigen die Organismen eine veränderte Genexpression, die unter anderem mit einer erhöhten Pathogenität einhergehen kann [3–5].
Je nach Vorkommen können Biofilme eine Vielzahl von Problemen auslösen. In technischen Systemen drohen zum Beispiel Verstopfungen von Rohrleitungen, die Bildung von isolierenden Ablagerungen auf Wärmetauschern sowie die Korrosion von metallischen Oberflächen. Im medizinischen Bereich können Biofilme schwerwiegende Infektionen auslösen, beispielsweise eine Kathetersepsis durch in Kathetern wachsende Biofilme [6, 7]. Ähnlich problematisch sind mikrobielle Beläge auf medizinischen Implantaten oder auf dem Operationsbesteck, auch wenn diese nicht in jedem Fall als Biofilme im engeren Sinne anzusehen sind. Schließlich gibt es auch in modernen Haushalten (Küche, Bad) viele Nischen, in denen Biofilmbildung auftreten und zu ästhetischen (Verfärbungen, schlechte Gerüche), aber auch zu potentiellen gesundheitlichen Beeinträchtigungen führen kann. Biofilme in Haushaltstoiletten bilden beispielsweise ein potentielles Reservoir für Krankheitserreger wie Salmonellen [8].
Diese Biofilmproblematik hat zur Entwicklung von entsprechenden Gegenmaßnahmen geführt. Zur Verhinderung der Bildung von Biofilmen sowie zur Entfernung reifer Biofilme werden dabei häufig mechanische Methoden (Putzen der Oberfläche), aber auch antimikrobielle Beschichtungen (z. B. mit Silber oder Kupfer), aggressive Desinfektionsmittel (z. B. Wasserstoffperoxid, Hypochlorit) oder Hitze verwendet. Diese Verfahren sind allerdings nicht universell einsetzbar. Zudem kann ihre (zu häufige) Anwendung die zu reinigende Oberfläche schädigen und die Umgebung belasten [9–11]. Gegenwärtig werden daher weitere Strategien erforscht und zum Teil bereits angewendet, wie zum Beispiel die Nanostrukturierung von Oberflächen (Lotus-Effekt), die Reinigung mit Plasma (partiell ionisierte Gase, oftmals bei stark erniedrigtem Druck) oder Angriffe auf den Biofilm mithilfe von biologischen Reagenzien wie EPS-abbauender Enzyme (z. B. Proteasen), Bakteriophagen und Quorum-Sensing-Blockern, welche die Kommunikation der Mikroorganismen untereinander stören sollen [12–15]. Die hohe Resistenz von Biofilmen gegen solche Reinigungsmethoden ist allerdings bekannt. Hinzu kommt, dass diese Methoden je nach Verfahren aggressiv, technisch anspruchsvoll und teuer sein können. Darüber hinaus können sie sowohl das zu reinigende Material angreifen, als auch Anwender und Umwelt nachhaltig belasten. Eine Anwendung durch Laien ist ebenfalls oftmals noch ausgeschlossen. Ultima ratio ist und bleibt daher auch heute noch die regelmäßige mechanische Entfernung von Biofilmen. Schwierigkeiten ergeben sich dann aber vor allem bei schwer zugänglichen Stellen [3–5].
2 Elektrische und elektrochemische Methoden gegen Biofilme
Elektrische beziehungsweise elektrochemische Methoden spielen als Strategien gegen mikrobielle Biofilme bislang nur eine sehr untergeordnete Rolle [3–5]. Dies ist überraschend, da solche Methoden eine Reihe von Vorteilen bieten und betroffene Oberflächen oft elektrisch leitend sind [16, 17]. Als entscheidende Vorteile sind die geringen Konstruktions- und Betriebskosten solcher Verfahren, ihre leichte und gefahrlose Anwendbarkeit (bei niedrigen Spannungen) und ihre Umweltfreundlichkeit zu nennen. Hinzu kommt, dass sich mit elektrischen und elektrochemischen Verfahren eine Vielzahl von unterschiedlichen Wirkprinzipien gegen Biofilme verwirklichen lassen, die nachfolgend näher ausgeführt werden.
Ein besonderer Aspekt, der alle elektrischen und elektrochemischen Methoden von den meisten anderen verfügbaren Techniken deutlich unterscheidet, ist die Tatsache, dass elektrischer Strom ein Objekt als Ganzes von innen heraus reinigt, indem der Biofilm sowie andere auf der Oberfläche vorhandene Ablagerungen von unten angegriffen werden. Bei leitenden Oberflächen treten ab einer Mindestspannung, ab der die kapazitive Helmholtz-doppelschicht durchbricht, Elektronen aus dem leitenden Material nach außen und erreichen daher auch kleinste Risse oder Spalten. Dadurch ist eine Reinigung beziehungsweise Dekontamination auch an mechanisch schwer oder gar nicht erreichbaren Stellen möglich. Zugleich findet die Reinigung lokal statt, das heißt die Menge an Strom und/oder elektrochemisch erzeugten reaktiven Spezies ist im Vergleich zu extern von außen applizierten Chemikalien vergleichsweise gering.
Unter den verschiedenen Ansätzen verdienen es vier Verfahren, die sowohl mechanisch als auch chemisch den Biofilm angreifen, besonders hervorgehoben zu werden:
- elektrisches Aufladen einer Oberfläche und elektrostatische Abstoßung von Mikroorganismen und Biofilm
- Wegblasen eines Biofilms durch in situ Gasentwicklung, entweder durch anodische Erzeugung von Sauerstoff oder durch kathodisch erzeugten Wasserstoff
- anodische Erzeugung von reaktiven Chlorverbindungen
- kathodische Erzeugung von reaktiven Sauerstoffverbindungen (Abb. 1)

Abb. 1: Vereinfachter schematischer Aufbau einer prototypischen elektrochemischen Reinigungsanlage, wie sie zum Beispiel für die grundlegenden Machbarkeitsstudien verwendet worden ist. Der zu reinigende Biofilm (biologisches Material) befindet sich in der Nähe des Kathodenraumes, der hier räumlich durch das Diaphragma (z. B. ein Dialysebeutel) abgegrenzt ist
Diese Verfahren werden häufig auch unterteilt in spannungsbasierende und strombasierende Verfahren. Die spannungsbasierenden Verfahren üben durch elektrisches Aufladen der Oberfläche einen elektrostatischen, elektrophoretischen und elektroosmotischen Einfluss auf Mikroorganismen aus, greifen sie aber nicht direkt an. Hingegen kommt es bei den strombasierenden Verfahren zur Übertragung von Elektronen, das heißt zu einem direkten oder indirekten Angriff auf die Mikroorganismen oder den Biofilm.
3 Elektrische Aufladung und elektrostatische Abstoßung
Bei den spannungsbasierenden Verfahren wird die zu schützende oder zu reinigende Oberfläche elektrisch aufgeladen. Da die Oberfläche von Mikroorganismen negativ geladen ist, kommt es zu einer Abstoßung der Bakterien von den ebenfalls negativ geladenen, das heißt kathodisch geschalteten Oberflächen. Diese Abstoßung beruht dabei in der Hauptsache auf elektrostatischen, elektrophoretischen und elektroosmotischen Phänomenen. Sie tritt bereits bei Oberflächenladungen von weniger als 6 µC/cm2 auf [18]. Entscheidend ist dabei, dass bei dieser Methode keine (!) Elektronenübertragung stattfindet, das heißt, dass weder die Mikroorganismen, noch der Biofilm oder die umgebende Lösung elektrochemisch reagieren. Diese Methode hat viele Vorteile, von den sehr niedrigen Spannungen und damit verbundenen geringen Kosten bis hin zur Abwesenheit von aggressiven Chemiekalien. Es ist daher wenig überraschend, dass solche Verfahren bereits häufig zum Einsatz kommen. Beispielsweise werden sie eingesetzt, um Biofouling an Schiffsrümpfen zu verhindern [19, 20].
Ein weiteres vielversprechendes Anwendungsgebiet ist die Medizintechnik. Solche spannungsbasierenden Methoden können verwendet werden, um mikrobielles Wachstum auf metallischen oder anderweitig den elektrischen Strom leitenden Implantaten oder OP-Bestecken zu verhindern [18]. Allerdings wirken diese Verfahren nicht bakterizid, sodass Mikroorganismen zwar von Oberflächen abgestoßen und ferngehalten, aber nicht abgetötet werden.
Daher werden vermehrt auch alternative Methoden in Betracht gezogen, die technisch vergleichsweise einfach mit einem solchen spannungsbasierenden Verfahren kombiniert werden können. Der einfachste Ansatz beinhaltet dabei den periodischen Wechsel von negativer und positiver Aufladung der betreffenden Oberfläche, das heißt die sukzessive Verwendung von negativen und positiven Spannungsblöcken, wie sie von van der Borden et al. (2004) und Hong et al. (2008) beschrieben wurden [17, 18]. Solche Blockverfahren sind relativ einfach durchzuführen, da sich bei elektrischen Verfahren Polarität und Höhe der Spannung einfach ändern lassen. In den letzten Jahren sind sie dementsprechend häufig untersucht worden [17, 18, 21]. Dabei hat sich gezeigt, dass es bei einer anodischen (positiven) Aufladung der Oberfläche erwartungsgemäß nicht zu einer Abstoßung der Bakterien per se kommt. Bei höheren anodischen Stromdichten (vor allem bei sehr kleinen Querschnittsflächen des Leiters), zum Beispiel mit Stromdichten um 50 µA/cm2, kommt es allerdings zu Elektronenübertragungen, durch welche die Mikroorganismen vermutlich direkt oder indirekt abgetötet werden [22].
Die genaue Ursache von solchen bakteriziden Wirkungen anodischer Ströme ist häufig noch unklar, kann aber beispielsweise durch eine direkte anodische Oxidation der Bakterienoberfläche oder durch die anodische Erzeugung aggressiver Verbindungen erklärt werden. Nachteil dieses Verfahrens ist allerdings, dass die Überreste der abgetöteten Mikroorganismen auf der Oberfläche verbleiben, zum Teil sogar zu der positiv geladenen Oberfläche hin gezogen werden, und damit einen idealen Nährboden für die Ansiedlung weiterer Mikroorganismen bilden. Die Schwierigkeiten einer rein kathodischen Aufladung (Abstoßung ohne Abtötung) und einer rein anodischen Aufladung (Abtötung ohne Abstoßung der Überreste) lassen sich zum Beispiel dadurch lösen, dass Polarität und Stärke der Aufladung alterniert werden. Die Feinheiten von solchen Blockverfahren werden daher zurzeit intensiv erforscht.
4 Wirkung von Gasentwicklung
Bei der anodischen Schaltung der Oberfläche im Blockverfahren treten bereits Elektronenübertragungen und damit elektrochemische Prozesse auf. Diese elektrochemischen Prozesse, die im Vergleich zu den elektrostatischen Methoden bei etwas höheren Spannungen auftreten, sind durchaus facettenreich und im Kontext der Dekontamination vielseitig einsetzbar.
Im ersten Ansatz wird eine Belastung mit relativ hoher Spannung betrachtet. Bei einer Potentialdifferenz ΔE von mehr als etwa 2 V zwischen Kathode und Anode kommt es in wässriger Lösung an den gängigsten leitenden Oberflächen, wie beispielsweise Kupfer oder Edelstahl, zu einer Zersetzung von Wassermolekülen und damit zur Erzeugung von Wasserstoffgas an der Kathode und von Sauerstoffgas an der Anode. Obwohl weder Wasserstoff noch Sauerstoff per se sonderlich bakterizid zu wirken scheinen (im Fall von Wasserstoff ist hierzu in den meisten Fällen noch wenig bekannt, im Fall von Sauerstoff können anaerobe Bakterien im Biofilm durchaus abgetötet werden), kommt es durch die Gasentwicklung an der Grenzfläche zwischen Metall und Biofilm zu einem mechanischen Angriff auf den Biofilm, der durch die Gasblasen von der Oberfläche abgelöst und in Stücken quasi weggeblasen beziehungsweise weggedrückt wird.
Ein solches Verfahren entspricht in seiner Wirkung grundsätzlich der kathodischen Abstoßung negativ geladener Bakterien von einer negativ geladenen Oberfläche. Es ist aber deutlich aggressiver und kann Oberflächen beschädigen. Die Oberfläche eines unedlen Metalls, wie zum Beispiel Eisen, kann so beispielsweise anodisch oxidiert oder kathodisch mit einem Metall durch galvanische Abscheidung beschichtet werden. Außerdem entstehen hier reaktive Gase (wenngleich auch in geringen Mengen) und der Verbrauch an Elektrizität ist, im Vergleich zu den spannungsbasierenden Verfahren, höher. Deutlich mildere anodische und kathodische Verfahren sind daher weiter in den Blickpunkt der Forschung gerückt.
5 Anodische Erzeugung von reaktiven Chlorverbindungen
Bei anodischen Verfahren hat sich die elektrochemische Forschung dabei vor allem auf die anodische Erzeugung von reaktiven Chlorverbindungen (RCS) durch Oxidation von Chlorid (Cl-) konzentriert [23–25]. Obwohl es eine ganze Bandbreite von in wässriger Lösung durch Oxidation erzeugbaren aggressiven Chemikalien gibt, kommt den reaktiven Chlorverbindungen eine besondere Rolle zu. Zum einen ist Chlorid preiswert und häufig in der Umwelt, auch in Biofilmen, vorhanden. Außerdem sind die Spannungen, bei denen Chlorid zu Chlor beziehungsweise Chlorgas (Cl2) oxidiert wird, relativ gering. Die zugrunde liegende Chemie ist gut bekannt, das heißt, die anodische Erzeugung von Chlorgas, die anschließende partielle Redox-Disproportionierung des erzeugten Chlors zu Chlorid und Hypochlorit (-OCl) sowie die biologischen und biochemischen Auswirkungen solcher reaktiver Chlorverbindungen sind gut erforscht und bieten wenig Raum für (unangenehme) Überraschungen. Hypochlorit ist beispielsweise wesentlicher Bestandteil von vielen Haushalts- und vor allem Toilettenreinigern. Seine bakterizide Wirkung ist umfassend dokumentiert und eine lokale Erzeugung hoher Konzentrationen dieses Reinigers an von Biofilmen bewachsenen Oberflächen zerstört Biofilme daher sehr effektiv.
Die anodische Oxidation von Chlorid zu Chlor wird daher bereits vielseitig eingesetzt: von der chemischen Reinigung von Abwässern in der Farbindustrie bis hin zur Reinigung in innovativen Waschmaschinen [24–27]. Die Methode ist zwar einfach, kostengünstig und effektiv, hat aber den Nachteil, dass giftige, zum Teil gasförmige Stoffe entstehen und bei umfassenderer Anwendung der Nutzer im Haushalt und die Umwelt durch das erzeugte Chlor/Hypochlorit belastet werden.
Ferner können die an der Anode erzeugten aggressiven Chemikalien dort zu einer signifikanten Korrosion führen. Letztendlich ist die Korrosionsproblematik allen anodischen Verfahren gemein und erfordert gewisse Vorsichtsmaßnahmen. Metallische Oberflächen sind davon besonders betroffen, aber auch leitende Polymere können durch Oxidation oder oxidativ erzeugte reaktive Verbindungen direkt oder indirekt angegriffen werden. Die Verwendung edler oder passivierter Metalle kann hier prinzipiell Abhilfe schaffen; die Verwendung von Silber, Gold oder gar Platin ist zwar im Labormaßstab möglich, in der Praxis aus Kostengründen jedoch meist ausgeschlossen.
6 Kathodische Erzeugung von reaktiven Sauerstoffverbindungen
Sollte die anodische Erzeugung aggressiver, bakterizider Verbindungen nicht möglich sein, so bieten kathodische Verfahren eine interessante Alternative. Die kathodische Erzeugung von Wasserstoff bei höheren Spannungen wurde bereits genannt (Abschnitt 4). Die elektrochemische Spaltung von Wasser zu Wasserstoff und Sauerstoff führte dabei zu einer reduzierend wirkenden Verbindung, nämlich Wasserstoff. Hingegen führt die serielle Reduktion von elementarem, in Wasser gelöstem Sauerstoff zur Bildung von sogenannten reaktiven Sauerstoffverbindungen (Reactive Oxygen Species, ROS, Abb. 2). Dazu gehören: das Superoxidradikal Anion (O2–•), Wasserstoffperoxid (H2O2) und das Hydroxylradikal (OH•), die aus Sauerstoff durch die Übertragung von jeweils einem, zwei oder drei Elektronen entstehen. Wasser (H2O) entsteht dabei nur, wenn auf ein Sauerstoffmolekül (O2) vier Elektronen gleichzeitig übertragen werden. Dies ist grundsätzlich möglich, aber nicht zwingend erforderlich, und hängt neben dem Elektrodenmaterial von einer Reihe von Parametern ab.

Abb. 2: Kathodische elektrochemische Dekontamination von leitfähigen Werkstoffen durch unterschiedliche, kombinierbare Prozesse: elektrostatische Abstoßung (A), elektrochemische Reduktion (B), Bildung von reaktiven Spezies an der Kathode (C) (z. B. auch durch eine anschließende Fenton-Chemie durch Metallsalze katalysierte Oxidation organischer Substrate mit Wasserstoffperoxid), Abreinigung von biologischem Material durch entstehendes Wasserstoffgas
Werden kathodisch weniger als vier Elektronen gleichzeitig auf Sauerstoff übertragen, entstehen paradoxerweise reaktive Sauerstoffverbindungen, die im Vergleich zum Sauerstoff zwar teilweise reduziert sind, selbst aber meist oxidierend wirken. In der Tat ist die Oxidationskraft von Wasserstoffperoxid mit der von Chlor vergleichbar, und beide werden vom Hydroxidradikal in Reaktivität und Aggressivität noch deutlich übertroffen.
Entscheidend ist, dass dieses scheinbare Paradox reduktiv erzeugter oxidierender Verbindungen in der Praxis ausgenutzt werden kann, wobei im Vergleich zu den anodisch erzeugten reaktiven Chlorverbindungen folgende Vorteile zum Tragen kommen:
- Reaktive Sauerstoffverbindungen werden kathodisch erzeugt, wodurch die Metalloberfläche nicht elektrochemisch oxidiert und von den aggressiven reaktiven Verbindungen auch nicht korrodiert wird
- Zur Erzeugung von reaktiven Sauerstoffverbindungen ist kein redox-aktives Salz erforderlich, denn Ausgangsverbindung im kathodischen Verfahren ist der im Wasser bereits reichlich vorhandene Sauerstoff. Die Leitfähigkeit wird dabei durch einen gering konzentrierten, frei wählbaren Elektrolyten (z. B. Phosphat oder Bikarbonat), wie er normalerweise in Leitungswasser vorkommt, sichergestellt
- Die reaktiven Sauerstoffverbindungen sind allesamt natürlich und kommen in geringen Konzentrationen auch in der menschlichen Zelle vor
- Die reaktiven Sauerstoffverbindungen sind nicht gasförmig und zerfallen nach einer kurzen Zeit, sodass keine Langzeitbelastung entsteht
Im Gegensatz zu den anodischen Verfahren ist die kathodische Erzeugung von reaktiven Sauerstoffverbindungen daher einfacher und schonender für die Oberfläche und für die Umwelt.
Die kathodische Reduktion ist von den Autoren in der Vergangenheit intensiv erforscht worden und hat bereits zu verschiedenen Patentanmeldungen geführt [28, 29]. Um solche Verfahren sinnvoll anwenden zu können, spielen neben dem Elektrodenmaterial auch die elektrische Spannung und die Zusammensetzung der wässrigen Lösung eine wichtige Rolle. So ist bei den durchgeführten grundlegenden Untersuchungen der letzten zehn Jahre deutlich geworden, dass die Erzeugung von reaktiven Sauerstoffverbindungen an verschiedenen metallischen Oberflächen auch mit technisch einfachen elektrischen Geräten und elektrochemisch inerten Salzen möglich ist. In diesem Zusammenhang konnte beispielsweise das Tripeptid GSH effektiv zerstört werden (Abb. 3). Dabei zeigte sich auch, dass die Anwesenheit von Sauerstoff für diese Methode essenziell ist.
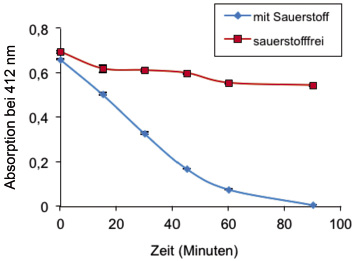
Abb. 3: Elektrochemische Zerstörung des Tripeptids Glutathion (GSH) mithilfe einer kathodisch geschalteten metallischen Oberfläche (GSH wird mithilfe von Ellmans Reagenz photospektrometrisch quantifiziert); es wird weit mehr GSH abgebaut, als an der Oberfläche der Kathode direkt angelagert sein kann, das heißt es kommt zusätzlich zu einer Reinigung der Lösung
Ferner war es möglich, das im Blut vorkommende Protein Albumin in der Nähe der Kathode abzubauen, während das selbe Protein in der Nähe der Anode nicht wesentlich zerstört wurde (Abb. 4). Interessant ist dabei, dass eine Reinigung an der Kathode auftritt, während die Anode nicht betroffen ist, und dass an der Kathode eine eventuell mögliche Korrosion ausbleibt (Abb. 5). Darüber hinaus ist es den Autoren vor kurzem gelungen, die Erzeugung von reaktiven Sauerstoffverbindungen mit der von Wasserstoff zu koppeln, was gerade im Bereich der Biofilmproblematik sehr vielversprechend ist.

Abb. 4: Abbau des im Blut vorkommenden Proteins Albumin (0,5 mg/ml) an der metallischen Oberfläche eines chirurgischen Instruments: Das ursprünglich nahe der Metallkathode im Dialysebeutel vorhandene Albumin ist nach zehn Stunden vollständig verschwunden (oben); Im Gegensatz dazu findet nahe der Graphitanode keine signifikante Zerstörung des Proteins statt, das dort auch nach über acht Stunden noch ähnlich konzentriert im Dialysebeutel nachgewiesen werden kann (unten); M = Proteinmarker, 20 µl Albuminlösung auf 10 % SDS Gel und Färbung durch Coomassie Blau

Abb. 5: Kathodische elektrochemische Reinigung von chirurgischen Instrumenten, die über Nacht in einer myoglobinhaltigen Pufferlösung bei Raumtemperatur gelagert, dadurch mit Myoglobin kontaminiert und anschließend gereinigt wurden: REM-Aufnahme der kontaminierten Oberfläche ohne vorherige elektrochemische Dekontamination (A) und der Oberfläche nach vierstündiger kathodischer Dekontamination (B). Die Oberfläche zeigt hierbei keinerlei negative Einflüsse der elektrochemischen Behandlung, wie etwa Korrosion
Ein besonderes Augenmerk der Forschungsaktivitäten liegt dabei auf praktischen Anwendungen im Bereich der Medizintechnik. Beispielsweise kann chirurgisches Besteck mit diesem Verfahren effektiv gereinigt werden, da an Oberflächen haftende Proteinkontaminationen zerstört werden. Dabei tritt bei kathodischer Schaltung neben der Reinigung die bereits angesprochene antikorrosive, oberflächenregenerierende Wirkung auf [28–30]. Ferner könnten grundsätzlich auch metallische Implantate mithilfe solcher Methoden im Körper keimfrei gehalten werden. Im Gegensatz zu Antibiotika sind Resistenzbildungen gegen reaktive Sauerstoffverbindungen aufgrund der sehr unspezifischen Wirkungsweise dieser Verbindungen nicht zu erwarten.
Ähnliche Anwendungen sind aber zum Beispiel auch im Haushalt denkbar, etwa zur Zerstörung von Biofilmen an Armaturen und in Abflüssen. Dort ist insbesondere die Zugänglichkeit ein Problem. Abläufe in Spülen sind nur schwer von unästhetischen und zumeist schlecht riechenden Biofilmen zu reinigen und der Einsatz von scharfen Reinigern in der Edelstahlspüle kann längerfristig zu Schäden an der Metalloberfläche führen. Massive Biofilme sind nur schwer komplett zu zerstören, widerstehen häufig auch Behandlungen mit kochendem Wasser und regenerieren sich vergleichsweise schnell. Ein integriertes, batteriebetriebenes Verfahren, das quasi im Hintergrund arbeitet und reinigende reaktive Sauerstoffverbindungen über kathodische Reduktion freisetzt, könnte hier effektive Abhilfe schaffen. Die Studien der Autoren haben gezeigt, dass ein solches Verfahren relativ einfach und effektiv umzusetzen ist.
Wichtig ist dabei, dass die reaktiven Sauerstoffverbindungen (primär O2–• und H2O2) bereits bei sehr niedrigen Spannungen von wenigen Volt (zwischen ca. -1,5 Volt und -2,0 Volt Potentialdifferenz zwischen Kathode und Anode) direkt an der Oberfläche des zu reinigenden Materials, das heißt unmittelbar dort, wo die Elektronen aus dem Material austreten, entstehen. Dies ermöglicht eine gründliche Reinigung auch an allen mechanisch schwer beziehungsweise nicht zugänglichen Stellen. Da das Verfahren Feuchtigkeit benötigt, ist es genau an Stellen mit vermehrtem Biofilmwachstum wirksam, wegen der dort natürlich vorhandenen erhöhten Feuchtigkeit und dem erhöhtem Elektrolytgehalt, während trockene (elektrolytfreie) Stellen nicht beeinflusst werden.
Neben der Kathode als Arbeitselektrode wird selbstverständlich auch eine Anode benötigt, damit ein geschlossener Stromkreis erzeugt werden kann. Die bisherigen Arbeiten der Autoren haben gezeigt, dass eine solche Anode durchaus aus haushaltsüblichen Materialien, wie beispielsweise aus Aluminium oder Edelstahl bestehen kann. Auch wenn über diese Anoden der Stromfluss in den Elektrolyten erfolgt, werden keine reaktiven Chlorverbindungen erzeugt.
7 Zusammenfassung
Elektrische und elektrochemischen Dekontaminationsverfahren sind vielseitig und umfassend anwendbar. Sie sind vergleichsweise einfach einzusetzen und benötigen in der Praxis kaum mehr als eine leitende Oberfläche, eine Batterie und etwas Feuchtigkeit. Verglichen mit anderen zurzeit in der Diskussion befindlichen Verfahren zur effektiven Entfernung und Vorbeugung von Biofilmen, wie beispielsweise der Verwendung von Plasma, EPS-abbauenden Enzymen, Bakteriophagen und Quorum-Sensing-Blockern, bieten solche auf einem elektrischen Stromkreis beruhenden und von innen heraus wirkende Verfahren eine Vielzahl von Vorteilen. Dies gilt vor allem für die im Vergleich zu anodischen Ansätzen deutlich schonenderen kathodischen Verfahren. Es ist anzunehmen, dass solche Methoden in naher Zukunft vermehrt ihren Weg in die Praxis finden und in bestehende Systeme integriert werden können.
Die Autoren treten gerne mit interessierten Partnern aus Wissenschaft und Industrie in Diskussion, um mögliche Anwendungen zu erörtern und an der Gestaltung und anschließenden Umsetzung aktiv mitzuwirken.
Danksagung
Die Autoren danken der Universität des Saarlandes, der Universität Exeter (UK), der Fresenius Medical Care AG & Co. KGaA und dem Royal Cornwall Hospitals NHS Trust für den finanziellen Support, sowie Dr. Andrea L. Holme, Dr. Fiona H. Fry, Nader Amin, Lisa Resack und Sandra Hübgen für ihre technische Hilfestellung.
Literatur
[1] J. H. Jung, N. Y. Choi & S. Y. Lee: Biofilm formation and exopolysaccharide (EPS) production by Cronobacter sakazakii depending on environmental conditions; Food Microbiol 34 (2013) S. 70–80
[2] J. U. Kreft & J. W. Wimpenny: Effect of EPS on biofilm structure and function as revealed by an individual-based model of biofilm growth; Water Sci Technol 43 (2001) S. 135–141
[3] L. C. Simoes, M. Simoes & M. J. Vieira: Influence of the Diversity of Bacterial Isolates from Drinking Water on Resistance of Biofilms to Disinfection; Appl Environ Microbiol 76 (2010) S. 6673–6679
[4] M. Simoes, L. C. Simoes & M. J. Vieira: A review of current and emergent biofilm control strategies; Lwt-Food Science and Technology 43 (2010) S. 573–583
[5] Q. Yang, A. J. Porter, M. Zhang, D. J. Harrington, G. W. Black & I. C. Sutcliffe: The impact of pH and nutrient stress on the growth and survival of Streptococcus agalactiae; Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology 102 (2012) S. 277–287
[6] E. Presterl, A. J. Grisold, S. Reichmann, A. M. Hirschl, A. Georgopoulos & W. Graninger: Viridans streptococci in endocarditis and neutropenic sepsis: biofilm formation and effects of antibiotics; J Antimicrob Chemother 55 (2005) S. 45–50
[7] C. J. Diskin, T. J. Stokes, L. M. Dansby, L. Radcliff & T. B. Carter: Is systemic heparin a risk factor for catheter-related sepsis in dialysis patients? An evaluation of various biofilm and traditional risk factors; Nephron Clin Pract 107 (2007) S. c128–132
[8] J. Barker & S. F. Bloomfield: Survival of Salmonella in bathrooms and toilets in domestic homes following salmonellosis; Journal of Applied Microbiology 89 (2000) S. 137–144
[9] W. Liu, Z. Zuo, R. Ma & X. Zhang: Effect of mechanical cleaning of endotracheal tubes with sterile urethral catheters to reduce biofilm formation in ventilator patients; Pediatr Crit Care Med 14 (2013) S. e338–343
[10] K. Vickery, A. Deva, A. Jacombs, J. Allan, P. Valente & I. B. Gosbell: Presence of biofilm containing viable multiresistant organisms despite terminal cleaning on clinical surfaces in an intensive care unit; J Hosp Infect 80 (2012) S. 52–55
[11] C. J. Holmes, A. Degremont, W. Kubey, P. Straka & N. K. Man: Effectiveness of various chemical disinfectants versus cleaning combined with heat disinfection on Pseudomonas biofilm in hemodialysis machines; Blood Purif 22 (2004) S. 461–468
[12] S. Sillankorva & J. Azeredo: Bacteriophage Attack as an Anti-biofilm Strategy; Methods Mol Biol 1147 (2014) S. 277–285
[13] K. A. Hughes, I. W. Sutherland & M. V. Jones: Biofilm susceptibility to bacteriophage attack: the role of phage-borne polysaccharide depolymerase; Microbiology 144 ( Pt 11) (1998) S. 3039–3047
[14] S. Yang, O. A. Abdel-Razek, F. Cheng, D. Bandyopadhyay, G. S. Shetye, G. Wang & Y. Y. Luk: Bicyclic brominated furanones: a new class of quorum sensing modulators that inhibit bacterial biofilm formation; Bioorg Med Chem 22 (2014) S. 1313–1317
[15] D. J. Hassett, J. F. Ma, J. G. Elkins, T. R. McDermott, U. A. Ochsner, S. E. West, C. T. Huang, J. Fredericks, S. Burnett, P. S. Stewart, G. McFeters, L. Passador & B. H. Iglewski: Quorum sensing in Pseudomonas aeruginosa controls expression of catalase and superoxide dismutase genes and mediates biofilm susceptibility to hydrogen peroxide; Mol Microbiol 34 (1999) S. 1082–1093
[16] D. Freebairn, D. Linton, E. Harkin-Jones, D. S. Jones, B. F. Gilmore & S. P. Gorman: Electrical methods of controlling bacterial adhesion and biofilm on device surfaces; Expert Review of Medical Devices 10 (2013) S. 85–103
[17] S. H. Hong, J. Jeong, S. Shim, H. Kang, S. Kwon, K. H. Ahn & J. Yoon: Effect of electric currents on bacterial detachment and inactivation; Biotechnol Bioeng 100 (2008) S. 379–386
[18] A. J. van der Borden, H. C. van der Mei & H. J. Busscher: Electric-current-induced detachment of Staphylococcus epidermidis strains from surgical stainless steel; J Biomed Mater Res B Appl Biomater 68 (2004) S. 160–164
[19] T. Matsunaga, T. Nakayama, H. Wake, M. Takahashi, M. Okochi & N. Nakamura: Prevention of marine biofouling using a conductive paint electrode; Biotechnol Bioeng 59 (1998) S. 374–378
[20] T. Nakayama, H. Wake, K. Ozawa, N. Nakamura & T. Matsunaga: Electrochemical prevention of marine biofouling on a novel titanium-nitride-coated plate formed by radio-frequency arc spraying; Applied Microbiology and Biotechnology 50 (1998) S. 502–508
[21] T. Nakayama, H. Wake, K. Ozawa, H. Kodama, N. Nakamura & T. Matsunaga: Use of a titanium nitride for electrochemical inactivation of marine bacteria; Environmental Science & Technology 32 (1998) S. 798–801
[22] A. T. Poortinga, R. Bos & H. J. Busscher: Controlled electrophoretic deposition of bacteria to surfaces for the design of biofilms; Biotechnol Bioeng 67 (2000) S. 117–120
[23] C. Rabinovitch & P. S. Stewart: Removal and inactivation of Staphylococcus epidermidis biofilms by electrolysis; Appl Environ Microbiol 72 (2006) S. 6364–6366
[24] D. Rajkumar & J. G. Kim: Oxidation of various reactive dyes with in situ electro-generated active chlorine for textile dyeing industry wastewater treatment; Journal of Hazardous Materials 136 (2006) S. 203–212
[25] G. H. Chen: Electrochemical technologies in wastewater treatment; Separation and Purification Technology 38 (2004) S. 11–41
[26] H. Sarkka, M. Vepsalainen, M. Pulliainen & M. Sillanpaa: Electrochemical inactivation of paper mill bacteria with mixed metal oxide electrode; Journal of Hazardous Materials 156 (2008) S. 208–213
[27] K. H. Jung: Washing machine having electrolysis apparatus; WO/2004/065682 (2004)
[28] C. Jacob, F. H. Fry & A. L. Holme: Method of decontaminating, disinfecting or sterilizing of an article by means of an electrolytic system or by reactive oxygen species; US20070059197 A1 (2005)
[29] C. Jacob & F. H. Fry: Apparatus and process for removing destroying or reducing the growth of organic material; WO2006111771A3 (2006)
[30] T. Burkholz. Oxidativer Stress und elektrochemische Dekontaminations-Verfahren in der Dialyse; Doktor thesis, Universität des Saarlandes, (2010)
DOI: 10.7395/2014/Burkholz1
1) Bioorganische Chemie, Fachrichtung Pharmazie, Campus B 2.1., Universität des Saarlandes, D-66123 Saarbrücken; Tel: +49 (0)681 302 3129, E-Mail: c.jacob@mx.uni-saarland.de
2) Fakultät Medical and Life Sciences, AG Mikrobiologie und Hygiene, Campus Villingen-Schwenningen, Jakob-Kienzle-Straße 17, D-78054 Villingen-Schwenningen; Tel: +49 (0)7720 307 4554, E-Mail: Markus.Egert@
hs-furtwangen.de


