Für elektrotechnische und elektronische Bauteile ist der Einsatz von Edelmetallen unumgänglich. Vor allem Silber und Gold werden aufgrund ihrer guten Leitfähigkeit und den zuverlässigen Kontakteigenschaften benötigt. Zur Einsparung von Gold kommen einerseits Mehrfachschichtsysteme mit Palladium, Palladium-Nickel oder Nickel zum Einsatz. Zum anderen werden die Verschleißeigenschaften von Gold und Silber durch Legierungselemente verbessert. In geringerem Umfang werden Platin, Rhodium und Ruthenium eingesetzt, die ebenfalls gute Kontakteigenschaften und zudem eine hohe Härte sowie Verschleißbeständigkeit besitzen. Heute steht eine breite Auswahl an Beschichtungsverfahren zur Verfügung, mit denen sowohl dünnste Schichten mit guter Wirkung als auch Formteile aus Edelmetall, zum Beispiel in MID-Bauteilen, hergestellt werden können.
Precious Metals for Technical Surfaces – an Overview of their Properties
In many cases, the use of precious metals in electrical and electronic components is unavoidable. In particular, silver and gold, on account of their good electrical conductivity and their reliability as contact materials, are often mandatory. A reduction in gold use can be achieved, for example, by use of multilayer systems with palladium, palladium-nickel or nickel itself. On the other hand, the tribological properties of gold and silver can be improved by alloying. In a limited number of cases, platinum, rhodium and ruthenium are used, all of which have good electrical contact properties as well as high hardness and wear resistance. Today, a wide choice of coating processes is available, some of which offer good performance even with the thinnest coatings as well as applications where the components themselves are made of precious metals, for example in MID assemblies.
Edelmetalle, allen voran Gold, waren und sind vor allem Schmuck und Geldanlage. Mit Aufkommen der Elektronik und der Katalysatortechnik in Fahrzeugen sind Edelmetalle zunehmend auch zu technisch wichtigen Werkstoffen geworden. Inzwischen sind vor allem elektronische Geräte ohne den Einsatz des Edelmetalls Gold nicht mehr zu realisieren, so dass die Rückgewinnung von Gold und einigen anderen Edelmetallen zu einer wichtigen Größe im Recyclingprozess geworden ist. Die Galvanotechnik trägt entscheidend dazu bei, einerseits die positiven Eigenschaften der Edelmetalle auszunutzen und andererseits durch deren effizienten Einsatz die Kosten geringzuhalten.
Im vorliegenden Beitrag wird der Blick auf die Eigenschaften der Edelmetalle gerichtet, wie sie sich bei der Herstellung mit den chemischen und elektrochemischen Verfahren ergeben. Dabei wird auch gezeigt, mit welchen Verfahren die Optimierung des Einsatzes möglich gemacht wird.
1 Industrielle Verwendung von Edelmetallen
Edelmetalle finden vor allem aufgrund ihrer guten Beständigkeit gegen Korrosion und Oxidation Anwendung. Bei Silber ist die gute Leitfähigkeit ein wichtiger Grund für dessen Verwendung. Des Weiteren eignen sich Edelmetalle gut zur Herstellung von Lötverbindungen, was in erster Linie auf das Fehlen von Deckschichten in Form von Oxiden zurückzuführen ist, da die Edelmetalle an Luft keine Oxidschicht bilden.
Im technischen Bereich werden Edelmetalle vor allem in der Elektrotechnik und Elektronik eingesetzt. Tabelle 1 zeigt an einigen wenigen Zahlen die verwendeten Einsatzmengen im Bereich der Elektronik und Elektrotechnik. Dabei ist zu berücksichtigen, dass die Einsatzmengen stark vom jeweiligen Marktpreis der Metalle abhängen. Dies gilt insbesondere für Palladium, das bei hohen Goldpreisen als Alternative dient, ansonsten aber keinen merklichen Vorteil bringt. Dies ist nur bedingt mit den geförderten oder zum Verbrauch verfügbaren Edelmetallmengen verbunden. Häufiger schlägt sich hier die Neigung zur Wertanlage oder Anlagenspekulation nieder, aber auch der Umrechnungskurs zwischen den Währungen.
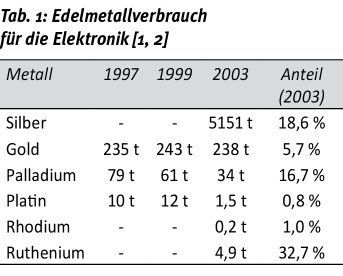
Insbesondere der starke Anstieg im Bereich der elektronischen Kleingeräte (Mobiltelefon, Tabletcomputer) hat in den letzten Jahren zu einem zunehmenden Verbrauch bei Gold und Palladium geführt. Platin und Rhodium werden dagegen in großem Maßstab für Katalysatoren, vor allem in Fahrzeugen, verwendet. Auch hier werden aufgrund der hohen Preise (Tab. 2) für Platin und Rhodium große Anstrengungen unternommen, um zu geringstmöglichen Einsatzmengen pro Bauteil, das heißt zu einer höchstmöglichen Effizienz, sowie zu einem bestmöglichen Recycling zu kommen.

2 Edelmetalle in der Galvanotechnik
Die Galvanotechnik zeichnet sich vor allem dadurch aus, dass mit der Technologie aus einfachen Ausgangsstoffen Metalle in einer sehr geringen Dicke aufgetragen werden können. Dadurch lassen sich die Eigenschaften der Edelmetalle – gute Korrosions- und Oxidationsbeständigkeit und damit keine Deckschichtbildung, geringer Kontaktwiderstand, gute Lötfähigkeit – bei geringem Materialeinsatz auf andere Metalle, welche diese Eigenschaften nicht aufweisen, übertragen. Je nach Anwendung werden die gewünschten Resultate mit Schichtdicken ab 0,1 Mikrometer (1 Mikrometer
= 10-6 Meter) erreicht. Eine porenfreie galvanische Schicht kann ab Dicken von etwa zwei Mikrometer bis fünf Mikrometer erzielt werden. Dies bedeutet, dass mit einer Menge von 38 Gramm Gold eine Fläche von 1 Quadratmeter mit einer zwei Mikrometer dicken Goldschicht belegt werden kann.
Zwar wird auch die mechanische Beschichtung von Metallen mit Edelmetallen wie Gold oder Silber vorgenommen. Dieses so genannte Plattieren ist aber im Vergleich zur galvanischen Beschichtung zeitaufwendiger und nur bei größeren Flächen, wie Bändern, Blechen oder Rohren, sinnvoll anwendbar. Mit Hilfe der galvanotechnischen Verfahren können dagegen nahezu alle Geometrien mit einer variablen Schichtdicke versehen werden. Ganz besonders zu betonen ist die Möglichkeit, auch partiell Edelmetall aufzutragen, was beispielsweise bei der galvanotechnischen Bandbeschichtung zum Herstellen von Kontakten in großem Maßstab betrieben wird – hierzu findet sich in der vorliegenden Ausgabe 10/2013 der WOMag ein Beitrag von Thomas Frey.
Dieser besonders effiziente Einsatz von Edelmetallen war auch der Grund dafür, dass sich die ersten Verfahren der Galvanotechnik, die 1840 zum Patent angemeldet wurden, mit der galvanischen Abscheidung von Gold und Silber befassten [2]. Die Hauptherausforderung bei der galvanotechnischen Edelmetallabscheidung besteht in der Herstellung von geeigneten wasserlöslichen Edelmetallverbindungen. Dies ist insbesondere deshalb schwierig, weil die Edelmetalle gegen chemische Angriffe eine hohe Resistenz aufweisen und deshalb auch korrosionsbeständig sind. Gold und Silber können in erster Linie in Form von cyanidischen Verbindungen in Wasser gelöst werden. Bei den Platinmetallen ist die Herstellung von Verbindungen mit Chlor und Sulfat bekannt; so lässt sich Platin nur mit einer Mischung aus Salz- und Schwefelsäure auflösen und liegt dann als lösliches Hexachloroplatinat vor. Cyanid als lösliche Verbindung für Gold und Silber liegt als Bestandteil in Mandeln vor, weshalb archäologische Forschungen davon ausgehen, dass bereits im Altertum galvanische Abscheidungen mit Hilfe der so genannten Batterie der Parther vorgenommen worden sein könnten [4, 5].
Gold und Silber werden zur galvanotechnischen Abscheidung nach wie vor in Form von Cyanidverbindungen eingesetzt. Im Falle von Gold, dessen Verbindung Kaliumgoldcyanid in einem breiten pH-Bereich (ab circa pH 3 bis in den stark alkalischen Bereich) stabil ist, stehen zahlreiche Möglichkeiten zur galvanischen Abscheidung von Gold und Goldlegierungen zur Verfügung. Bei Gold ist seit einigen Jahren auch eine Verbindung auf Basis von Sulfit verfügbar, die allerdings weniger stabil ist und infolgedessen zum Ausfällen von Gold aus der wässrigen Lösung und damit zum Goldverlust führt. Silber wird nach wie vor nahezu ausschließlich aus cyanidischen Lösungen abgeschieden. Für die Platinmetalle wird auf Verbindungen mit Chlor oder Sulfat zurückgegriffen. Die Abscheidungen erfolgen meist aus sauren oder stark sauren wässrigen Lösungen.
Der Abscheidevorgang erfolgt in allen Fällen so, dass ein gut gereinigtes metallisches Werkstück durch Tauchen in eine Säure aktiviert – darunter ist in der Regel das Entfernen der natürlichen Oxidhaut zu verstehen – und dann in den Abscheideelektrolyten eingetaucht wird. Zwischen Werkstück und einer zweiten metallischen Elektrode wird ein Gleichstromkreis mit Hilfe eines entsprechenden Gleichrichters aufgebaut. Das Werkstück ist hierbei die Kathode, an der Elektronen an der eingetauchten Metalloberfläche zur Verfügung gestellt werden. Mit Hilfe der Elektronen werden die in der Lösung befindlichen Edelmetallionen, beispielsweise das gelöste Goldcyanid, zu neutralen Metallatomen reduziert (Abb. 1). Die Metallatome lagern sich dann auf der Werkstückoberfläche zu einem geschlossenen Metallfilm ab. Der erforderliche Stromfluss wird über die Gegenelektrode geschlossen. Je nach Art des verwendeten Abscheideelektrolyten kann dort Metall in Lösung gehen (z. B. bei der Silberabscheidung) oder eine nicht störende Anodenreaktion (z. B. die Sauerstoffentwicklung im Falle der Goldabscheidung) ablaufen.

Abb. 1: Schematische Darstellung der galvanischen Metallabscheidung
Die Abscheidegeschwindigkeiten für die galvanische Metallabscheidung liegen im Bereich zwischen 0,1 und etwa 1,0 Mikrometer pro Minute. Sie hängen unter anderem davon ab, aus welcher Wertigkeitsstufe das Metall abgeschieden wird. Für Gold sind dies die Wertigkeitsstufen 1 und 3 (Au+ und Au3+) und für Silber die Wertigkeitsstufe 1 (Ag+). Die Wertigkeitsstufe gibt an, wieviele Elektronen zur Umwandlung des Metallions in das Metallatom erforderlich sind. Ein weiteres Kriterium für eine hohe oder niedere Abscheidegeschwindigkeit ist der Wirkungsgrad, das heißt der Anteil an unerwünschten Nebenreaktionen, wie der Wasserstoffentwicklung. Für spezielle Verfahren, wie zum Beispiel die Bandbeschichtung, wurden Hochgeschwindigkeitsverfahren entwickelt, bei denen die Abscheidegeschwindigkeit bis zu 100 Mikrometer pro Minute betragen kann [2].
Die Abscheidegeschwindigkeiten geben einerseits einen Anhaltspunkt dafür, wie lange der Beschichtungsprozess dauert. Sie zeigen aber auch, dass die gewünschte Schichtdicke relativ genau einstellbar ist, was vor allem für den effizienten Einsatz von teuren Edelmetallen wichtig ist.
3 Edelmetallschichten und deren Eigenschaften
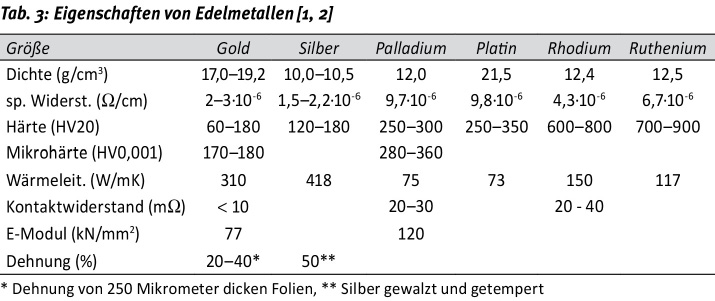
Das hervorstechende Merkmal der Edelmetalle ist ihre chemische Beständigkeit, woraus sich für die Anwendung in der Elektrotechnik die guten elektrischen Kontakteigenschaften ergeben. Die elektrische Leitfähigkeit selbst ist bei Silber besonders hoch. Hauptnachteil der Edelmetalle ist die relativ hohe Dichte, weshalb aufgrund des hohen Preises die Kosten für den Materialeinsatz stark ins Gewicht fallen. In Tabelle 3 sind einige interessante Eigenschaften zusammengefasst.
3.1 Silber
Silber besitzt die höchste elektrische Leitfähigkeit aller Metalle. Damit ist ein Einsatz von Silber in massiver Form sowie von galvanisch abgeschiedenen Silberschichten für die Übertragung von hohen Strömen prädestiniert. Der Einsatz selbst wird daraufhin ausgewählt, dass zwischen den technisch zu erfüllenden Eigenschaften und dem Preis für das Edelmetall, der allerdings am unteren Ende der Preisliste liegt (Tab. 1), optimiert wird.
Vor allem für Schraubverbindungen in der Hochfrequenztechnik werden galvanisch abgeschiedene Silberschichten verwendet. Darüber hinaus lässt sich Silber gut löten und bonden und eignet sich damit für Kontaktflächen auf Verbindungselementen oder den Kontakten in der Mikroelektronik [1, 7]. Teilweise wurden auch Untersuchungen durchgeführt, um Leiterzüge und Durchkontaktierungen bei Leiterplatten durch galvanische Silberabscheidung herzustellen. Hier kommt die gute Streufähigkeit der Verfahren positiv zum Tragen, das heißt, die Abscheidung erfolgt auch in engen Spalten und Löchern, die bei weniger geeigneten Verfahren durch Abschirmeffekte zu geringe Stromdichten an der Oberfläche aufweisen.
In größerem Umfang wird Silber als Legierungselement beispielsweise mit Zinn für Lötverbindungen in der Elektronik eingesetzt. Vor allem durch die Verbannung von Blei als Lotwerkstoff stellt Silber neben Kupfer ein wichtiges Metall für die Verbindungstechnik dar. Dazu wurden galvanische Verfahren entwickelt, mit denen sich Zinn-Silber-Legierungen mit etwa 3 % bis 4 % Silber herstellen lassen. Die Legierungen schmelzen bei etwa 210 °C bis 230 °C und liegen damit geringfügig höher als die klassischen Zinn-Blei-Legierungen mit einem Schmelzpunkt von 183 °C.
Für mechanische Verbindungen kann das relativ weiche reine Silber durch Zulegieren von weiteren Metallen erhöht werden. Allerdings sinkt hier natürlich die elektrische Leitfähigkeit, weshalb nur mit geringen Legierungsgehalten von wenigen Prozent gearbeitet wird. Oftmals werden solche Legierungen – beispielsweise Silber-Wolfram (2 At.% W) – wärmebehandelt und erzielen dann eine gute elektrische Leitfähigkeit [7]. Ein weiteres Verfahren zur Verbesserung der Abriebbeständigkeit ist die Mitabscheidung von Hart- oder Schmierstoffen. Für Schaltelemente wurden galvanische Silberschichten mit Einlagerungen von Graphit, Nanodiamanten und Nanoaluminiumoxid hergestellt, die eine deutliche Reduzierung des Verschleißes zeigten [8].
Dünne Schichten im Bereich bis etwa 200 Nanometer bis 300 Nanometer können auch durch chemische Abscheidung beispielsweise aus Silbernitratlösungen erfolgen. Dieses Verfahren wurde bereits vor 200 bis 300 Jahren zur Herstellung von Spiegeln eingesetzt, indem Glas mit einer dünnen Silberschicht belegt wurde. Als Reduktionsmittel kann Formaldehyd eingesetzt werden, wodurch die Versilberung aller benetzter Oberflächen innerhalb kürzester Zeit erfolgt. Die Reduktion wird aber auch durch Licht ausgelöst, weshalb beispielsweise auch eine Initiierung lokal durch Laserlicht möglich ist.
3.2 Gold
Gold ist für technische Anwendungen vor allem deshalb interessant, weil es an Luft unter atmosphärischen Bedingungen nicht oxidiert, also im metallischen Zustand beständig ist. Zum anderen bildet Gold aber auch keine Oxidschicht und erfährt dadurch keine Verändungen im Aussehen und in Bezug auf die elektrische Kontaktierung. Die elektrische Kontaktierung ist zwar auch bei anderen Metallen prinzipiell gegeben, allerdings entsteht bei den meisten Metallen eine elektrisch nicht leitende Oxidschicht, die bei niedrigen Spannungen erhalten bleibt, teilweise erst bei höheren (deutlich über 10 V bis 50 V) durchschlagen wird. Goldoberflächen stellen dagegen auch bei niedrigster Spannung (weit unter 1 V) keinen elektrischen Widerstand dar. Dies macht Goldoberflächen für den Niederspannungsbereich, in dem elektronische Schaltungen arbeiten, so interessant. Die selbe Eigenschaft verhilft Gold auch dazu, von metallischen Loten benetzt zu werden oder beim Schweißen von Feinstdrähten einen stets gleichen elektrischen Widerstand zu bilden.



Abb. 2: Phasendiagramm von Gold-Antimon [9] (links) und Änderung des spezifischen elektrischen Widerstands und der Härte Gold-Antimon
Andererseits führen die hohen Materialkosten von Gold dazu, dass eine Verwendung auf das notwendige Mindestmaß beschränkt wird. Hier bietet die Abscheidungstechnik gute Ansätze, da dünnste Schichten von wenigen Atomlagen bis zu einigen Mikrometern präzise und gleichbleibend hergestellt werden können. Des Weiteren bieten nahezu alle Beschichtungsarten Möglichkeiten, durch Legieren mit weniger kostenintensiven Metallen den Anteil des eingesetzten Goldes zu verringern.
3.2.1 Abscheidung von Gold und Goldlegierungen
Lange Zeit waren Gold und Goldlegierungen nahezu ausschließlich aus cyanidischen Goldverbindungen abscheidbar. Cyanid besitzt den großen Vorteil, dass es in der Lage ist, Gold direkt aus der metallischen Form aufzulösen und zugleich eine stabile Verbindung zu bilden, die in Wasser gelöst einen Elektrolyten zur galvanischen Abscheidung von Gold mit sehr vorteilhaften Eigenschaften ergibt. Zu den entsprechenden Elektrolyten können weitere Metallsalze hinzugegeben werden, um Legierungen mit Silber, Kobalt oder Nickel mit hoher Stromausbeute und in gut einstellbarer Zusammensetzung galvanisch abzuscheiden. Zugleich sind verbrauchte cyanidische Goldelektrolyte einfach zu entsorgen und das gesamte Edelmetall kann zurückgewonnen werden.
Einziger Nachteil der cyanidischen Verbindungen ist die starke Toxizität des Cyanids. Zur Vermeidung dieses Nachteils wurde seit etwa 30 Jahren zunehmend an alternativen Verbindungen geforscht, so dass heute für die Goldabscheidung beispielsweise auch Elektrolyte auf Basis von Sulfid verfügbar sind. Entscheidender Nachteil von Sulfid ist die geringere Beständigkeit, so dass Goldausfällungen beispielsweise bei Einwirkung von Licht oder Wärme auftreten. Damit steigen die Kosten für die Goldabscheidung erheblich und der Verlust an Gold nimmt zu.
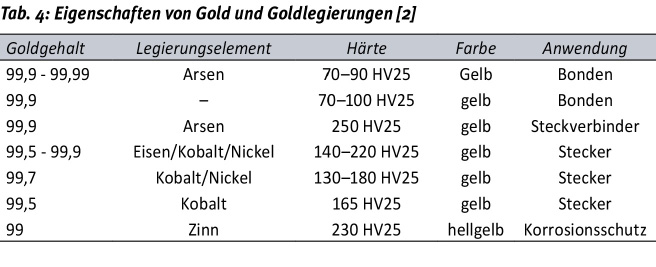
Die technischen Anwendungen von Gold und Goldlegierungen zum Schutz von Oberflächen gegen Korrosion werden auch mit Goldlegierungen von bis zu etwa 30 % Anteil an Fremdmetallen erreicht. Allerdings sinkt damit auch die Beständigkeit bei thermischer Belastung, was sich in der Bildung von Deckschichten aus Oxidationsprodukten der Legierungspartner zeigen kann. Zugleich sinkt damit auch die Lötfähigkeit und insbesondere die Bondfähigkeit. Aus diesem Grund wird für elektrische und elektronische Kontaktflächen bevorzugt mit hochreinen Schichten gearbeitet. Bevorzugt werden Legierungen mit Nickel und Kobalt, wobei der Legierungsanteil deutlich unter 1 % liegt. Daneben werden aber auch Bestandteile von Zusätzen (z. B. so genannte Kornfeiner oder Glanzzusätze) eingebaut, die ebenfalls Einfluss auf die mechanischen Eigenschaften haben. Legierungen zeichnen sich in den meisten Fällen durch deutlich höhere Härten im Vergleich zu unlegiertem Gold aus (Tab. 4). Den Zusammenhang zwischen Härte und Leitfähigkeit in Abhängigkeit der Zusammensetzung zeigt Abbildung 2 beispielhaft für den steigenden Gehalt an Antimon in Gold. Die beiden Metalle sind bis zu einem Anteil von etwa 65 % Antimon ohne Bildung von intermetallischen Phasen ineinander mischbar. Es zeigt sich damit auch, dass durch eine gezielte Einstellung der galvanischen Legierungsabscheidung die beiden Eigenschaften Härte und elektrische Leitfähigkeit optimierbar sind.
3.2.2 Aufbau von Schichtsystemen mit Gold
Die Anforderungen an technische Goldschichten zielen in erster Linie auf einen niederen Kontaktwiderstand und hohen Korrosionsschutz. Der elektrische Widerstand prinzipiell – also der Widerstand senkrecht zur Schichtoberfläche – kommt kaum zum Tragen, da Goldschichten aus Kostengründen sehr dünn abgeschieden werden und die hauptsächliche Stromleitung vom darunter liegenden Metall übernommen wird. Angestrebt wird daher bei Goldschichten stets die dünnstmögliche Schicht bei gleichzeitiger Gewährleistung der Anforderungen Korrosionsschutz, elektrische Kontaktierung, Bond- und Lötfähigkeit oder Verschleißbeständigkeit.
In der Elektrotechnik spielen als Substrat vor allem die Metalle Kupfer und Silber sowie für einige Anwendungen auch Aluminium eine Rolle. Vor allem mit Kupfer und Silber ist Gold gut mischbar, so dass auch bei Raumtemperatur an der Grenzfläche zwischen Kupfer und Gold beziehungsweise Silber und Gold die Metalle ineinander diffundieren. Dabei gehen sowohl die Eigenschaften Korrosionsschutz als auch geringer Kontaktwiderstand im Gebrauch verloren, wobei eine erhöhte Gebrauchstemperatur den Vorgang stark beschleunigt. Als Diffusionssperre wird im Allgemeinen Nickel eingesetzt, aber auch eine Palladium- oder Palladium-Nickel-Schicht erfüllen diese Aufgabe [1].
Insbesondere Kontaktflächen auf elektronischen Bauteilen, besonders bei lösbaren Verbindungen und Steckern, werden mit Edelmetallbeschichtungen versehen. Hierbei wird bei Kleinbauteilen die Herstelltechnologie des Bandgalvanisierens eingesetzt. Mit zahlreichen Technologien [10] können heute Abscheidungen auf kleinsten Flächen mit hoher Genauigkeit vorgenommen und somit der Verbrauch an Edelmetallen auf ein Minimum reduziert werden.
Darüber hinaus werden hierbei Kombinationsschichten aufgebracht. Je nach Anforderung in Bezug auf die weitere Verwendung als reiner Steckkontakt oder als Löt- beziehungsweise Bondfläche (Abb. 3) sind Kombinationen aus Nickel, Nickel-Phosphor, Palladium oder Palladium-Nickel mit Gold, Gold-Nickel oder Gold-Kobalt gebräuchlich. Palladium und Palladium-Nickel dienen hier in erster Linie als Ersatzstoff für Gold sowie als Diffusionssperre. Nickel und Nickel-Phosphor erhöhen die Beständigkeit gegen Verschleiß der Beschichtung sowie gegen Korrosion des Substrats.

Abb. 3: Leiterplatte mit einer Kombinationsschicht aus Nickel und Gold
Neue multifunktionale Beschichtungen für elektrische Kontakte erreichen beispielsweise mit einer Kombination aus chemisch abgeschiedenem Nickel, chemisch abgeschiedenem Palladium und chemisch abgeschiedenem Gold ein Maximum an Edelmetalleinsparungen [11]. Hinzu kommt bei solchen Schichten ein sehr vorteilhaftes Verhalten in Bezug auf die Verbindungstechnik, da das System sowohl beim Golddrahtbonden als auch beim Löten sehr gute Eigenschaften besitzt (Abb. 4 und 5). Die Minimierung des Goldverbrauchs zeigt sich bei der eingesetzten Goldschichtdicke von etwa 50 Nanometer!

Abb. 4: MID-Bauteile mit Oberfläche aus chemisch abgeschiedenem Nickel, Palladium und Gold

Abb. 5: Leiterplatte mit Kontaktflächen aus chemisch abgeschiedenem Nickel, Palladium und Gold
Bei allen Systemen mit Mehrfachschichten ist allerdings zu berücksichtigen, dass sich der produktionstechnische Aufwand erhöht, da der Abscheideprozess mit jeder zusätzlichen Metallschicht um einige Schritte (evtl. Aktivierung, chemische oder galvanische Abscheidung, Spülstufen) erhöht wird.
3.3 Palladium und Palladiumlegierungen
Palladium ist vor allem durch seine hohe Aufnahmefähigkeit von Wasserstoff gekennzeichnet. Da Wasserstoff als Begleitelement bei der galvanischen Abscheidung neben dem Metall stets gebildet wird, entstehen bei reinen Palladiumschichten durch den eingebauten Wasserstoff innere Spannungen. Diese führen wiederum zur Entstehung von Mikrorissen [2].
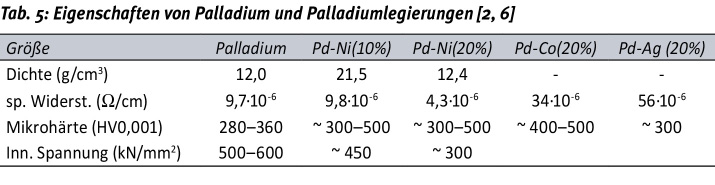
Die Aufnahme von Wasserstoff sinkt mit steigendem Anteil an Legierungsmetallen. Eine Legierung aus Palladium mit etwa 15 % Nickel zeigt infolgedessen auch keine Rissbildung. Daher wird Palladium für Beschichtungen vorzugsweise als Legierung eingesetzt. Gebräuchlich ist die Legierung mit Nickel, die heute verbreitet zur Einsparung von Gold zum Einsatz kommt. Darüber hinaus stehen auch Verfahren zur Abscheidung von Palladium-Silber und Palladium Kobalt zur Verfügung. Palladium – hergestellt durch galvanische und chemische (stromlose) Abscheidung – und Palladium-Nickel [1, 11] sowie Palladium-Kobalt [9] finden nahezu ausschließlich als Zwischenschicht unter der abschließenden Goldschicht Anwendung. Derartige Zwischenschichten unterbinden die Diffusion von Gold in das Substrat und zeichnen sich durch eine höhere Härte und eine gute Verschleißbeständigkeit aus. In Tabelle 5 sind einige Eigenschaften von Palladium- und Palladiumlegierungsschichten zusammengestellt.
3.4 Platin und Rhodium
Platin und Rhodium lassen sich galvanisch Abscheiden und zeichnen sich durch gute Verschleißbeständigkeiten aus. Inbesondere bei galvanisch abgeschiedenem Rhodium wurden Härten von 800 kg/mm2 bis 1000 kg/mm2 gemessen und damit Werte erreicht, die über denen von Chrom liegen [6]. Allerdings liegt der Preis von Rhodium häufig über dem von Gold [13], weshalb ein Einsatz nur unter hohen Verschleiß- und Abbrandbedingungen sinnvoll ist, zum Beispiel bei speziellen Kontakten [1]. Platin oder Platin-Iridium [14] sind sehr temperaturbeständig und eignen sich deshalb für Bauteile, die einer hohen Temperaturbelastung ausgesetzt sind. Darüber hinaus wird Platin aufgrund der guten mechanischen Eigenschaften neben Palladium auch für die Herstellung von Mikrobauteilen in der Mikrosystemtechnik eingesetzt [12]. Hierbei kann die Abscheidung so modifiziert werden, dass spannungsarme Abscheidungen entstehen, so dass die Mikrobauteile sowohl ihre Form beibehalten als auch mechanische Belastungen ohne Bruchversagen überstehen.
Wesentlich größer ist die eingesetzte Platinmenge im Bereich der Katalysatoren, beispielsweise zur Abgasreinigung in Kraftfahrzeugen. Allerdings wird hier Platin nicht durch galvanotechnische Methoden verarbeitet [13].
4 Zusammenfassung
Vor allem in der Elektronik sind Edelmetalle nach wie vor unersetzbar. Da sie jedoch in der Regel nur an der Oberfläche von Kontakten oder Leitungsbahnen zur Aufrechterhaltung eines guten elektrischen Kontakts, der Vermeidung von Oxidation und Korrosion oder zur Gewährleistung der Bond- und Lötfähigkeit benötigt werden, ist die galvanotechnische Abscheidung eine optimale Technologie zur Verarbeitung von Edelmetallen.
Silber als Metall mit der besten elektrischen Leitfähigkeit kommt vor allem für Kontakte und Bauteile für hohe Stromübertragungen zum Einsatz, unterliegt allerdings einer schnellen Bildung von störenden Deckschichten. Dagegen helfen nur Gold- und Goldlegierungsschichten. Sie sind aus diesem Grund auch das Metall der Wahl für elektronische Kontakte mit geringen Kontaktspannungen. Zur Einsparung von Edelmetall werden die Schichten nur direkt auf den notwendigen Oberflächenbereichen durch den Einsatz von speziellen Verfahren aufgebracht. Darüber hinaus eignen sich Kombinationsschichten aus Nickel und dem kostengünstigeren Edelmetall Palladium. Platin und Rhodium sind teure Edelmetalle, die für bestimmte hochbelastete Kontakte und bei Gefahr von höheren Temperaturbelastungen eingesetzt werden.
Danksagung
Die Autoren danken B. Endres für die bereitgestellten Fotografien.
Literatur
[1] B. Endres, in: Jahrbuch Oberflächentechnik, Band 62 (2006), S. 19–36
[2] H. Kaiser: Edelmetallschichten, S. 15 ff, Eugen G. Leuze Verlag, 2002
[3] Umicore Electroplating App, Umicore Galvanotechnik GmbH
[4] N. Kanani: The Parthian Battery; Eugen G. Leuze Verlag, 2004
[5] 50 Jahre DGO, Festschrift zum Jubiläum; Abschnitt 3.1, S. 61–63
[6] W. H. Safranek: The Properties of Electrodeposited Metals and Alloys; AESF 1986
[7] R. Freudenberger, in: Jahrbuch Oberflächentechnik, Band 60 (2004), S. 9–22
[8] U. Michelsen-Mohammadein, G. Steinborn, in: 22. Ulmer Gespräch 2000 – Innovative Mehrkomponentensysteme; Eugen G. Leuze Verlag
[9] Springer Link; Bulletin of Alloy Phase Diagrams; April 1984, Vol. 5, Issue 2, pp 166–171; Au-Sb System
[10] WOMag 2 (2013)10, www.womag-online.de/index.php/fachzeitschrift
[11] B. Endres; PLUS 11 (2009)11, S. 2654–2664; gleicher Beitrag auch in Galvanotechnik, 102 (2011)11, S. 2426–2436
[12] R. Freudenberger, in: Jahrbuch Oberflächentechnik, Band 64 (2008), S. 11–20
[13] A. Klotz; Galvanotechnik 102 (2011)1, S. 56–61
[14] R. Freudenberger, in Jahrbuch Oberflächentechnik, Band 61 (2005), S. 9-17
DOI: 10.7395/2013/Schade3



