Eine Einführung
Heute können Werkstoffwissenschaftler die Zusammensetzung von Partikeln mit einem Durchmesser von weniger als 100 Nanometern genau kontrollieren und auch ihre Größe exakt einstellen. Dadurch lassen sich optische, elektronische und physikalische Eigenschaften maßschneidern und an viele verschiedene Anwendungen anpassen. Insbesondere eröffnen solche als Quantenpunkte bezeichneten Nanopartikel völlig neue Möglichkeiten bei der Umwandlung von Sonnenstrahlung in elektrischen Strom.
Quantum Dots – New Material for Energy Prodution – An Introduction
Quantum dots are a new class of materials, small particles with a diameter below 100 nm whose size and composition can be well controlled. By changing the size one can adjust optical, electronic and physical properties in a wide range and adapt them to certain requirements. Quantum dots open up, amongst others, new possibilities for designing energy harvesting systems that could surpass today’s best systems’ efficiencies one day.
Nanopartikel mit einem Durchmesser unter 100 nm aus Werkstoffen wie Kadmiumselenid (CdSe), Kadmiumtellurid (CdTe), Zinksulfid (ZnS) oder Bleisulfid (PbS) haben überraschende physikalische Eigenschaften, denn Quanteneffekte wirken anders, wenn sich die geometrischen Abmessungen eines Körpers atomarer Größe nähern. Sie leuchten je nach Werkstoff und Größe in genau definierten Farben und können in Solarzellen die Nutzung eines weitaus größeren Teils des Sonnenspektrums ermöglichen als dies mit anderen Technologien möglich ist. Anwendung finden Quantenpunkte (QPs) in Farbdisplays, als Photodetektoren in der Optoelektronik oder zur Markierung von Geweben durch definierte Farben. Insbesondere die biochemische Anwendung, bei der Quantenpunkte mit anderen Molekülen gekoppelt werden und so beispielsweise als Marker für Krebszellen oder bestimmte Gewebe dienen, ist sehr interessant und wird heute bereits praktisch angewandt.
Grundprinzipien der Wechselwirkung von Quantenpunkten mit Photonen
Viele Quantenpunkte sind wesentlich kleiner als 100 nm. Ihr Durchmesser beträgt eher 1 nm bis 10 nm. Die oben beispielhaft genannten Materialien sind Halbleiter, sie haben also eine Bandlücke in ihrer elektronischen Struktur und damit Energieniveaus, die nicht von Elektronen besetzt werden können. Nimmt ein solcher Halbleiter von außen Energie auf, beispielsweise in Form eines Photons, so wird dadurch ein Elektron angeregt. Ist der Energiebetrag groß genug, dann kann das Elektron die Bandlücke überspringen und gelangt in das so genannte Leitungsband, in dem es sich frei im Kristall bewegen kann. Gelangen genügend Elektronen in das Leitungsband, so wird das Material zum Leiter. Wird ein Elektron in das Leitungsband gehoben, so hinterlässt es einen positiv geladenen Bereich, der sich ebenfalls durch den Kristall bewegen kann, sich ähnlich wie ein Teilchen verhält und als Loch bezeichnet wird. Für jedes angeregte Elektron entsteht genau ein Loch, diese Elektron-Loch-Paare werden Exzitonen genannt.
Der räumliche Abstand der beiden Ladungen lässt sich auf der Basis elektrostatischer Wechselwirkungen berechnen, so wie es Nils Bohr mit dem Abstand von Proton und Elektron im Wasserstoffatom getan hat. Daher heißt der geringste Abstand der Ladungen auch Bohr-Radius. Trifft ein Elektron im Leitungsband auf ein Loch, dann kann es zur Rekombination kommen und die Energiedifferenz zwischen Leitungsband und Grundzustand (Valenzband) wird als Photon abgegeben. Quantenpunkte sind in der Regel kleiner als der Bohr-Radius der Exzitonen, die in ihnen entstehen können. Aus diesem Grund können jeweils nur Exzitonen mit genau definierter Energie in den Quantenpunkten existieren, die bei ihrer Rekombination dann Strahlung einer genau definierten Wellenlänge aussenden. Je nach Material und Abmessungen der Quantenpunkte ändert sich diese Wellenlänge. Durch die Beeinflussung des Partikeldurchmessers lassen sich also bei geeigneten Werkstoffen verschiedene Farben herstellen. Das ist einer der Gründe, warum Quantenpunkte das Interesse von Forschern und Entwicklern auf sich ziehen. Mit ihnen kann durch einfache Kontrolle eines geometrischen Parameters ein interessanter elektronischer Parameter genau eingestellt werden. Der Bereich der Lichtwellenlängen, für die Quantenpunkte empfindlich sind, erstreckt sich vom infraroten über den sichtbaren Bereich bis zur UV-Strahlung. Daher können maßgeschneiderte Mischungen von Quantenpunkten einen sehr großen Bereich der solaren Strahlung nutzen. Alle heute technisch bei Solarzellen angewendeten Halbleiter können dagegen nur in einem jeweils begrenzten Bereich des Spektrums Photonen aufnehmen.

Nutzung hochenergetischer Photonen
Ein weiterer Effekt macht Quantenpunkte noch interessanter für Anwendungen in Solarzellen. Trifft ein sehr energiereiches Photon auf ein Halbleitermaterial, dann wird ein Elektron angeregt und in das Leitungsband gehoben, hat dann aber noch sehr viel Energie. Diese Energie lasst sich physikalisch als Temperatur interpretieren. Daher werden solche Elektronen auch als heiß (hot carrier) bezeichnet. Der Halbleiterwerkstoff kann dabei Raumtemperatur haben, denn es sind immer nur relativ wenige Elektronen in diesem heißen Zustand.
In normalen Halbleitern kommt es zu Wechselwirkungen zwischen den energiereichen Elektronen und den Löchern, wodurch die überschüssige Energie in Wärme umgewandelt wird. Dieser Prozess stoppt erst, wenn das Elektron nur noch so viel Energie hat, dass es gerade im Leitungsband bleiben kann. In Quantenpunkten kann es nun bei Wechselwirkung eines sehr energiereichen Elektron-Loch-Paares mit dem Kristallgitter zur spontanen Aufspaltung in zwei energieärmere Elektron-Loch-Paare kommen, ein Effekt, der als Aufprallionisation (impact ionization) bezeichnet wird. Auf diese Weise können energiereiche Photonen in mehrere Elektronen und zugehörige Löcher umgewandelt und ihre ganze Energie in Form von Ladungsträgern genutzt werden. Die Aufprallionisation spielt vor allem dann eine Rolle, wenn im Quantenpunkt Werkstoffe enthalten sind, welche freie Löcher einfangen und sozusagen energetisch binden, so dass sie nicht mehr so einfach mit Elektronen wechselwirken können. Über diesen Mechanismus können mit Hilfe von Quantenpunkten grundsätzlich deutlich größere Teile des Sonnenspektrums genutzt und in Energie umgewandelt werden.
Materialsysteme für Solarzellen
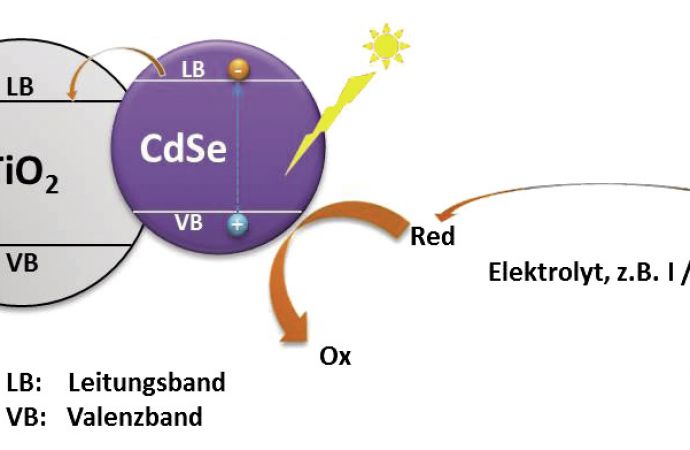
Für den Einsatz in Solarzellen müssen Quantenpunkte mit weiteren Halbleitermaterialien kombiniert werden, denn in den Partikeln werden die Ladungsträger zwar erzeugt, danach müssen sie aber separat und mit hoher Effizienz zu den zwei verschiedenen Elektroden geleitet werden. Dies wird meist durch eine Trägerstruktur aus Halbleitern wie Titandioxid oder Zinkoxid erreicht, allerdings lässt sich auch Graphen einsetzen, das mit Quantenpunkten gleichmäßig besetzt ist.
Durch die Halbleiterstruktur wird der Kontakt zu einer Elektrode gebildet, als leitende Verbindung zur anderen Elektrode wird meist ein Elektrolyt eingesetzt. Er leitet Elektronen zum Valenzband der Quantenpunkte, wo sie mit Löchern rekombinieren und somit wieder für die Anregung durch Photonen zur Verfügung stehen. Als Elektrolyt hat sich das Jod-Jodid-Redoxpaar (I/I-3) bewährt, alternativ verwenden verschiedene Arbeitsgruppen Polysulfid (Na2S), welches aber den Nachteil starker Korrosivität hat. Vor allem Quantenpunkte aus Kadmiumsulfid werden stark angegriffen und degradieren sehr schnell. Beide Elektrolyte sind nicht langzeitstabil, unter anderem daran scheitert bisher auch der Aufbau praktisch nutzbarer Solarzellen mit Quantenpunkten. An neuen Konzepten für Elektrolyte wird heute intensiv geforscht.
Herstellung von Quantenpunkten
Es gibt eine Vielzahl von Materialien, die für Quantenpunkte eingesetzt werden: CdS, CdSe, CdTe, CuInS2, Cu2S, PbS, PbSe, InP, InAs, Ag2S, Bi2S3, Sb3S2 und noch verschiedene andere. Grundsätzlich können die Partikel direkt auf der Trägerstruktur synthetisiert oder separat hergestellt und dann aufgebracht werden. Die direkte Herstellung hat den Vorteil einer sehr guten Anknüpfung des Quantenpunktmaterials an den Träger und damit einer effizienten Elektronenableitung. Nachteilig ist die relativ große Variation der Durchmesser der Quantenpunkte, welche zu unterschiedlichen Absorptionseigenschaften führt. Alternativ können die Quantenpunkte separat in einer Lösung hergestellt und dann durch Adsorption oder chemische Bindung an der Trägerstruktur befestigt werden.
Die direkte Synthese auf dem Träger erfolgt in einer Flüssigphasenreaktion, bei der die Ausgangsverbindungen in einer Lösung vorliegen, in welche die Trägerstruktur getaucht wird. Durch die Reaktion von metallhaltigen Precursoren beispielsweise mit Harnstoff, der über die Zeit Sulfid (S-2) freisetzt, lassen sich Metallsulfide herstellen. Grundsätzlich können mit dieser Methode aber auch Selenide erzeugt werden. In einem anderen Verfahren werden die anionischen und die kationischen Ausgangsverbindungen jeweils in sehr dünnen Schichten durch Tauchen aufgebracht und dazwischen wird gespült. Die geringen Mengen an Precursormolekülen, welche dabei zusammen kommen, verbinden sich zu dem gewünschten Halbleiter. Durch die Kontrolle der Zyklenzahl lässt sich die Größe der Quantenpunkte gezielt einstellen.
Die separate Herstellung von Quantenpunkten erfolgt meist bei erhöhten Temperaturen aus geeigneten metallorganischen Verbindungen und Inhibitoren, welche die temperaturbedingte Zersetzung kontrollieren und damit die Einstellung der Partikelgröße ermöglichen. An die Quantenpunkte werden in einem weiteren Schritt Verbindungsmoleküle angeheftet, die mit ihrem anderen Ende am Substrat verankert werden. Der Nachteil dieser Anordnung ist die Tatsache, dass die Elektronen nur über das Verbindungsmolekül in die Trägerstruktur gelangen können und damit eine geringere Effizienz gegeben ist als bei direktem Kontakt.
Quantenpunkte können auch durch direkte Adsorption an Trägerstrukturen gekoppelt werden, allerdings ist die Belegungsdichte dann sehr viel kleiner als bei den beiden anderen Methoden.
Neben den klassischen nasschemischen Methoden gibt es auch verschiedene elektrochemische Verfahren, um Quantenpunkte herzustellen. Sie lassen sich unterteilen in Abscheideverfahren, Ätzverfahren und elektrochemische Reduktionsverfahren. Bei den Abscheideverfahren werden Halbleiter aus den Hauptgruppen II-VI, IV-VI und I-VII verwendet und auf unterschiedlichen Substraten, wie beispielsweise Gold, Silizium oder Graphit, abgeschieden. Da während des diffusionskontrollierten Partikelwachstums die Wachstumsgeschwindigkeit jedes Partikels auch von der Größe und vom Wachstum seiner Nachbarn abhängt, ergibt sich ein komplexes gekoppeltes System, in welchem es durch kleine Unregelmäßigkeiten während der Keimbildung später zu großen Inhomogenitäten beim Partikeldurchmesser kommen kann. Um diese Kopplung der Einzelpartikel aufzuheben, wurden gepulste Prozesse eingeführt, in denen durch kurze Abscheidepulse von 8 ms bis 12 ms und Pausen von 1 s bis 5 s die Relaxation von Konzentrationsgradienten möglich war. Damit konnten Partikel mit sehr homogener Größenverteilung erzeugt werden. Die Metallpartikel werden in einem zweiten Schritt elektrochemisch oxidiert und danach wird der Sauerstoff verdrängt und die eigentlichen Quantenpunkte erzeugt.
Elektrochemische Ätzverfahren arbeiten mit Silizium- oder Graphitsubstraten. Silizium wird in einer Flusssäure-Ethanol-Mischung anodisch oxidiert und die erzeugte poröse Schicht wird mit Hilfe von Ultraschall zerstört und die Nanopartikel damit freigesetzt. In einer Erweiterung des Verfahrens wird auch Wasserstoffperoxid als Katalysator eingesetzt. Der gesamte Prozess ist sehr komplex und wird außer von der Zusammensetzung des Elektrolyten und den elektrochemischen Parametern auch von der Dotierung des Siliziumsubstrates und einer möglichen zusätzlichen Belichtung beeinflusst. Je nach dem verwendeten Substrat kann auch eine Nachbehandlung der Nanopartikel notwendig werden, um sie praktisch einsetzen zu können.
Auch Graphit lässt sich elektrochemisch ätzen, dabei entstehen Kohlenstoffnanopartikel. In wässrigen Elektrolyten bilden sie eine stabile Suspension, dies wird vermutlich durch eine hydrophile Oberflächenbelegung der Partikel beim Ätzprozess ermöglicht. Oft finden sich Carboxylgruppen auf der Oberfläche, welche die Kohlenstoffpartikel in einer wässrigen Lösung stabilisieren, so dass sie einfach weiterverarbeitet werden können. Allerdings haben durch Ätzen von Graphit hergestellte Kohlenstoffnanopartikel bedingt durch Inhomogenitäten des Substrates oft eine stark ungleichmäßige Größenverteilung und sind damit in der Praxis ohne Nachbehandlung kaum interessant.
Bei der elektrochemischen Reduktion werden Chlorsilane in organischen Lösemitteln elektrochemisch reduziert, so dass sich chemische Bindungen zwischen Siliziumatomen ausbilden können. Die entstehenden Netzwerke verdichten sich dann bis zu Nanopartikeln. Als Elektrode wird beispielsweise Magnesium eingesetzt. Allerdings ist dieses Verfahren chemisch sehr komplex und es ist schwierig, gezielt Quantenpunkte mit homogener Größe und einheitlichen Eigenschaften zu produzieren.

Das theoretische Limit für die Effizienz von Quantenpunktsolarzellen liegt ähnlich wie bei den Farbstoffsolarzellen im Bereich von 15 % bis 20 %. Allerdings sind bis heute in der Literatur nur Effizienzwerte von bis zu 4,5 % publiziert worden, die alle mit Zellen von weniger als einem Quadratzentimeter Fläche gemessen wurden. Insofern entsprechen die meisten Messungen nicht den Mindeststandards aus der Photovoltaik und können nicht als belastbare Daten herangezogen werden.
Quantenpunkte sind eine Materialklasse mit großem Potential, für die es heute in der Medizintechnik und der biologischen Forschung bereits konkrete Anwendungen gibt. Große Hoffnungen liegen auf der Nutzung von Quantenpunkten für Solarzellen, allerdings müssen die Forscher und Entwickler noch einige Herausforderungen meistern, bevor praxistaugliche und konkurrenzfähige Solarzellen herstellbar sind. Die Vielseitigkeit des Konzeptes der Quantenpunkte wird auch in Zukunft für großes Interesse an ihrer weiteren Erforschung sorgen. Der direkte Zugriff auf Quantenphänomene eröffnet dabei ein weites Feld für überraschende Entdeckungen.
Literatur zum Thema
S. Rühle, M. Shalom, A. Zaban: Quantum-Dot-Sensitized Solar Cells; ChemPhysChem (2010) 11, p. 2290–2304
A. J. Nozik: Quantum dot solar cells; Physica E, 14 (2002), p. 115–120
Y.-M. Long, Q.-L. Zhao, Z.-L. Zhang, Z.-Q. Tian, D.-W. Pang: Electrochemical methods – important means for fabrication of fluorescent nanoparticles; Analyst 137 (2012), p. 805–815
P. V. Kamat: Quantum Dot Solar Cells; Semiconductro Nanocrystals as Light Harvesters, J. Phys. Chem. C 112 (2008), p. 18737–18753
C. X. Guo, H. B. Yang, Z. M. Sheng, Z. S. Lu, Q. L. Song, C. M. Li: Layered Graphene/Quantum Dots for Photovoltaic Devices; Angew. Chemie Int. Ed. 49 (2010), p. 3014–3017
C. Li et al.: ZnO nanoparticle based hightly efficient CdS/CdSe quantum dot-sensitized solar cells; Phys. Chem. Chem. Phys. (2013) 15, p. 8710–8715
Y. Ye, C. Jo, I. Jeong, J. Lee: Functional mesoporous materials for energy applications: solar cells, fuel cells and batteries; Nanoscale (2013) 5, p. 4584–4605
DOI: 10.7395/2013/Brunel4