Zur Aufklärung von zahlreichen Krankheiten ist die Bestimmung der Neurotransmitterkonzentration mit Orts- und Zeitauflösung hilfreich. Dazu eignen sich Verfahren der Elektrochemie, da die entsprechenden zu analysierenden Stoffe in ionischer Form vorliegen. Bei diesen elektrochemischen Analysen spielt die Art der verwendeten Elektroden eine entscheidende Rolle. Diese muss garantieren, im Verlauf der Untersuchung keine schädigenden Stoffe abzugeben. Darüber hinaus muss die Oberfläche eine hohe Sensivität für die jeweilige Redoxreaktion aufweisen. Dies kann durch die Beschichtung der Elektroden realisiert werden, wobei unterschiedliche Beschichtungen bei gleichem Elektrodengrundmaterial die Möglichkeit bieten, die Art der detektierten Moleküle und die Empfindlichkeit der Detektion zu modifizieren. Für die zyklische Voltammetrie als Verfahren werden Elektroden auf Basis von Glaskohlenstoff mit Beschichtungen vorgestellt.
In-Vivo Neurotransmitter Detection Using Electrochemical Measurement Techniques
For an understanding and diagnosis of numerous illnesses, a measurement of neurotransmitter concentration with spatial- and time-resolution is invaluable. Electroanalytical techniques which determine the concentrations of various ionic species, are ideal for this purpose. The type of electrode used in such analyses is critical. Thus it is essential that such electrodes do not release any harmful materials when in use. Furthermore, the electrode surface must exhibit a high-sensitivity for the redox reaction in question. These criteria can be achieved by use of electrodes with a range of different coatings on the same electrode substrate thereby optimising sensitivity for whatever molecules are being detected. For cyclic voltammetry, electrodes based on glassy carbon are recommended with appropriate coatings.
1 Einleitung
In der vorliegenden Arbeit werden verschiedene Techniken genauer betrachtet, mit denen Neurotransmitter im Gehirn erfasst werden können. Die Informationen zu dieser Recherche stammen aus wissenschaftlichen Veröffentlichungen der letzten dreißig Jahre. Die behandelten Techniken sollen dazu beitragen, die Vorgänge im Gehirn genauer zu untersuchen, die im Zusammenhang mit verschiedenen Neurotransmittern stehen. Weiterhin ist ein Ziel, die Neurotransmitterfreisetzung nicht nur zu verstehen, sondern durch gezielte Stimulation zu überwachen und damit Krankheiten, die durch bestimmte Neurotransmitter beeinflusst werden, zu behandeln. Dabei ist entscheidend, wie und wo die Neurotransmitter freigesetzt werden und welche Aufgabe sie im Lebewesen haben. Darüber hinaus ist auch von Bedeutung, wie die Neurotransmitter sich gegenseitig beeinflussen und was zu ihrem Abbau führt.
Durch das Erforschen dieses Themas soll es möglich sein, Krankheiten, die durch einen Mangel oder Überschuss an Neurotransmittern entstehen, zu behandeln. Dies geschieht durch das Treffen der optimalen Therapieeinstellungen und die Hilfestellung bei neurochirurgischen Eingriffen. Entscheidend ist dabei die Platzierung von Elektroden, Ort und Art zur Stimulierung bestimmter Neuronengruppen sowie die beste Technik, um minimale und zeitlich sehr schnell ablaufende Prozesse zu erfassen. Zu diesem Zweck kommen elektrochemische Analyseverfahren zum Einsatz, die auch in technischen Bereichen zum Einsatz kommen.
Um die Bedeutung der Detektionsmethoden zu veranschaulichen, werden zunächst einige wichtige Neurotransmitter vorgestellt, sowie die Krankheiten, die mit ihnen in Verbindung stehen. Schließlich sind einige aktuelle Anwendungen in vivo aufgeführt, welche auf den beschriebenen Techniken basieren.
2 Neurotransmitter
Der Begriff Neurotransmitter leitet sich vom altgriechischen νεῦρον/neuron – Nerv und vom lateinischen transmittere – hinüberschicken beziehungsweise übertragen ab [1]. Neurotransmitter sind Botenstoffe, die an chemische Synapsen Informationen übertragen, weitergeben, verstärken oder modulieren. Die Ausschüttung dieser Botenstoffe erfolgt mithilfe von einlaufenden elektrischen Impulsen in die Synapse, die auch als Aktionspotentiale bezeichnet werden. Diese Aktionspotentiale werden im Folgenden in chemische Informationen umgewandelt und gleichzeitig verstärkt. Nach ihrer Ausschüttung werden die Neurotransmitter schnell enzymatisch inaktiviert, abgebaut oder wiederaufgenommen in das präsynaptische Nervenende [2].
Für den reibungslosen Ablauf von Synthese, Freisetzung, Wirkung und Wiederaufnahme der jeweiligen Neurotransmitter werden speziell auf ihn abgestimmte Maschinerien benötigt [2]. Dieser komplexe biochemische Ablauf kann durch Drogen, Medikamente und auch Gifte beeinflusst werden, zum Beispiel durch Transmitter-Rezeptoren-Aktivierung, Blockierung oder Wiederaufnahmehemmung [3]. Die Einteilung der Neurotransmitter erfolgt meist nach ihren chemischen Merkmalen in Monoamine oder auch biogene Amine genannt, Neuropeptide und Aminosäuren [3].
Zu den biogenen Aminen gehören Acetylcholin, Katecholamine wie Noradrenalin, Adrenalin, und Dopamin, sowie Serotonin, Dimethyltryptamin, Histamin, Melatonin, Octopamin und Tyramin [1].
Die Neuropeptide werden in verschiedene Unterklassen eingeteilt, den Opioiden, Schmerzunterdrückungssubstanzen, und Neurokinine, die auch unter dem Namen Tachykinine bekannt sind. Sie sorgen für eine schnelle Kontraktion der glatten Muskulatur und können auf das Hormonsystem, das Immunsystem, sowie das Nervensystem einwirken. Zu den Opioiden zählen die Endorphine und Enkephaline. Die Neurokinine beinhalten Neurokinin A, Neurokinin B und Substanz P. Weitere vorkommende Neuropeptide sind Oxytocin, Somatostatin, Vasopressin, Neuropeptid S, Neuropeptid Y, GHRH, Insulin und Glucagon.
Die Aminosäuren werden unterteilt in inhibitorische Aminosäuretransmitter und exzitatorische Aminosäuretransmitter. Die inhibitorischen Transmitter beinhalten γ-Aminobuttersäure, auch unter dem Namen GABA bekannt, Glyzin, β-Alanin, Taurin. Die exzitatorischen Aminosäuretransmitter enthalten Asparaginsäure, Gutaminsäure, die auch als Aspartat und Glutamat bezeichnet werden, sowie Cystein und Homocycstein.
Manche wichtigen Neurotransmitter, wie zum Beispiel Acetylcholin, können nicht in die zuvor genannten Einteilungen der biogenen Amine, Neuropeptide und Aminosäuren eingeordnet werden. So ist Acetylcholin der wichtigste Transmitter im peripheren Nervensystem [2]. In der vorliegenden Arbeit werden die Neurotransmitter Dopamin, Noradrenalin, Adrenalin, Glutamat, GABA, Acetylcholin, Adenosin und Serotonin genauer betrachtet.
2.1 Dopamin
Der für das zentrale Nervensystem wichtige Botenstoff Dopamin ist elektrochemisch aktiv und spielt eine besondere Rolle bei der Motorik, Motivation, Aufmerksamkeit, Emotion und bei kognitiven Prozessen sowie bei der Beeinflussung des Kardiovaskulären und Renalen Systems [4]. Durch ihn wird das Gehirn mit dem Körper sozusagen vernetzt.
Die Bildung erfolgt in den Nebennieren und in mehreren Bereichen im Gehirn beispielsweise durch Decarboxylierung von DOPA. Im Zentralnervensystem gibt es zwei dopaminerge Neuronengruppen, die von Bedeutung sind. Die eine befindet sich in der Substantia nigra (im Mittelhirn), sendet Axone ins Striatum und ist für die willkürliche Bewegungssteuerung zuständig. Das zweite dopaminerge System im ventralen Tegmentum (im Mittelhirn) sendet Axone in bestimmte Teile des Großhirns und des limbischen Systems.
Die mit diesem Transmitter in Zusammenhang gebrachten Krankheiten sind Schizophrenie, Depressionen, ADHS und Parkinson [5, 6]. Bei Parkinson führt ein Dopaminmangel in der Substantia nigra dazu, dass Bewegungsimpulse nicht mehr richtig weitergegeben werden [7]. Beim ADHS ist einen Dopaminmangel im frontalen Cortex zu erkennen.
2.2 Noradrenalin
Im Nebennierenmark und in Zellen des Locus coeruleus wird Noradrenalin aus Dopamin [8] produziert. Der Neurotransmitter ist elektrochemisch aktiv und wird oft mit Stress sowie Aufmerksamkeit und Wachheit in Verbindung gebracht. Die mit diesem Transmitter in Verbindung gebrachte Krankheit ist ADHS [7, 3].
2.3 Adrenalin
Adrenalin entsteht aus Dopamin [8] und wird im Nebennierenmark produziert. Es bewirkt eine Herzfrequenzsteigerung und bereitet somit den Körper auf Belastungen vor. Im Gehirn wirkt Adrenalin auch als Neurotransmitter (Botenstoff) [9, 2]. Dieser Neurotransmitter ist elektrochemisch aktiv.
2.4 Glutamat
Glutamat ist der wichtigste exzitatorisch, auch als erregend bezeichneter, Neurotransmitter, der zur Informationsübertragung zwischen Neuronen an deren Synapsen dient [3]. Dieser Transmitter ist für die Bewegungssteuerung, Sinneswahrnehmung und das Gedächtnis verantwortlich [7]. Ein Überschuss an Glutamat führt zu Zittern und Muskelsteifheit (Schizophrenie). Glutamat ist nicht elektrochemisch aktiv. Um es dennoch erfassen zu können, muss es zunächst mit Glutamat Oxidase reagieren, sodass ein elektrochemisch aktives Produkt, Hydrogen Peroxid, entsteht [6]. Durch Stimulierung des lokalen Thalamus kann Glutamat freigesetzt werden.
Mit diesem Transmitter in Zusammenhang gebracht werdende Störungen sind Epilepsie, Tremor und andere Bewegungsstörungen, sowie Alzheimer-Patienten, bei denen die Freisetzung und Aufnahme von Glutamat beeinträchtigt wird [3].
2.5 GABA
GABA ist der wichtigste inhibitorische, auch als hemmend bezeichneter, Neurotransmitter. Er dient zur Informationsübertragung zwischen Neuronen an deren Synapsen und setzt somit die Erregbarkeit der Nervenzelle herab. GABA ist der Gegenspieler von Glutamat [7]. Der Neurotransmitter ist auch elektrochemisch aktiv.
2.6 Acetylcholin
Das ebenfalls elektrochemisch aktive Acetylcholin ist der wichtigste Neurotransmitter im Gehirn. Weiterhin ist er zuständig für die Übermittlung von Nervenimpulsen zur Muskulatur sowie bei der Kontrolle der Atmung, des Herzschlags, des Stoffwechsels, der Aufmerksamkeit und der Erregbarkeit des Gehirns während des Schlaf- und Wachrhythmus [7].
Im Gehirn befinden sich cholinerge Neuronen, wobei die wichtigsten zu zwei Modulationssystemen zusammengefasst werden können. Das eine System innerviert vom Großhirn aus den Hippocampus, den Neocortex und den Riechkolben. Diese Zellen sterben als erstes bei der Alzheimer-Krankheit ab. Das zweite System besteht aus Zellen im Pons und im Tegmentum des Mittelhirns und wirkt in den Thalamus und ins Großhirn hinein [3].
2.7 Adenosin
Die körpereigene Substanz des Energiestoffwechsels Adenosin ist nicht elektrochemisch aktiv und blockiert die Ausschüttung der Neurotransmitter Noradrenalin, Dopamin und Acetylcholin. Damit führt Adenosin zur Blutgefäßerweiterung und zu einer Verlangsamung der Herzfrequenz. Bei Tremor und Epilepsie ist Adenosin wichtig [5, 3].
2.8 Serotonin
Serotonin (ST) oder auch 5-Hydroxytryptamine (5-HT) gilt auch als zentraler Stimmungsmacher und beeinflusst den Appetit, den Sexualtrieb, das psychische Wohlbefinden, das emotionale Befinden und es spielt eine maßgebende Rolle beim Schlaf- und Wachrhythmus [4]. Das elektrochemisch aktive Serotonin wird primär in den Raphé-Kernen des Mescencephalons im Hirnstamm produziert und ist dort nur in den Neuronen nachweisbar. Von dort werden alle Regionen mit den Axonen innerviert [3].
Krankheiten, die mit diesem Neurotransmitter assoziiert werden, sind Halluzinationen durch einen überhöhten Serotoninspiegel und Depressionen, Migräne, Angst und Aggressionen bei einem Serotoninmangel [10, 7]. Obwohl Serotonin in vielen Nahrungsmitteln enthalten ist, kann es nicht von der Blutbahn ins Gehirn gelangen, sondern wird dort aus der Aminosäure Tryptophan hergestellt. Der Tryptophanspiegel im Gehirn kann im Gegensatz zum Serotoninspiegel über die Ernährung beeinflusst werden [3].
3 Detektionsmethoden
Bei allen oben genannten Neurotransmittern sollte das zeitliche Verhalten und ihre Wirkungsweise beachtet werden. Dabei ist zu berücksichtigen, dass Acetylcholin, Serotonin und Dopamin etwas langsamer wirken und länger anhaltend als Glutamat, da sie nicht nur in jeweils einer einzelnen Synapse ausgeschüttet werden, sondern diffus in einem größeren Gebiet [3].
Im Rahmen der Arbeit werden zwei wichtige Bereiche der Neurotransmitterdetektion näher betrachtet. Zum einen die elektrochemische Detektion, die mithilfe von Elektroden Neurotransmitterkonzentrationen direkt im Gehirn misst. Im Folgenden wird genauer auf verschiedene Arten von Voltammetrie, Amperometrie und Redox-Cycling eingegangen. Zum anderen wird die Mikrodialyse betrachtet, bei der dem Gehirn Dialyseproben entnommen werden, welche im Anschluss außerhalb des Lebewesens auf Neurotransmitter untersucht werden [11].
3.1 Elektrochemische Detektionsmethoden
Schon in den frühen 1970er Jahren wurden die elektrochemischen Techniken entwickelt und in vielen verschiedenen Messungen von Neurotransmittern, wie zum Beispiel Dopamin oder Noradrenalin, sowie deren Stoffwechselprodukten verwendet. Auch Messungen im Gehirn lebender Tiere wurden bereits durchgeführt. Grundlage der elektrochemischen Techniken ist, dass elektrochemisch aktive Moleküle bei einem bestimmten Potential an der Spitze einer Elektrode oxidiert, beziehungsweise reduziert werden können. Dadurch entstehen Ströme, welche direkt proportional zur Konzentration des Stoffes sind. Es werden also relative Veränderungen der Neurotransmitterkonzentration erfasst. Mithilfe von Lösungen mit bekannter Konzentration können die Elektroden einfach kalibriert werden.
Elektrochemische Messungen sind sensitiv, relativ unkompliziert und haben eine hohe zeitliche Auflösung. Allerdings ist die räumliche Auflösung gering, da die Elektroden Neurotransmitter nur in ihrem direkten Umfeld detektieren. Andererseits kann diese räumliche Eingrenzung genutzt werden, um die lokale Neurotransmitterausschüttung direkt an der Freisetzungsstelle zu ermitteln. Dabei ist des Weiteren zu berücksichtigen, dass aufgrund der Distanz zwischen Elektrode und Freisetzungsstelle hoch reaktive oder unstabile Stoffe auf dem Weg zur Elektrode bereits mit anderen Molekülen reagieren und somit für die Messung verloren gehen können. Dazu kommt, dass die Elektrode die Membranlipide und -proteine verletzen kann; vor allem bei hohen Oxidationspotentialen. Auch können bereits die leichtesten Gewebekontraktionen dazu führen, dass an einer anderen als der vorgesehenen Stelle gemessen wird oder es zu einer mechanischen Stimulation kommt [12].
Jeder Neurotransmitter besitzt einen bestimmten Spannungsbereich, in welchem er nachgewiesen werden kann [13]. Dieser Bereich wird der Detektionsmethode entsprechend eingestellt. Alle auftretenden Ströme werden aufgezeichnet. Dazu gehören sowohl die durch Oxidation und Reduktion entstehenden Faradischen, als auch die kapazitiven Ströme, welche Nebenwirkungen der Spannungsveränderung sind. Diese störenden kapazitiven Ströme können durch eine präzise Background-Subtraktion eliminiert werden [8]. Dazu werden zunächst nur die Ströme aufgezeichnet, die auch ohne Konzentrationsänderung fließen. Anschließend wird die Neurotransmitterausschüttung stimuliert und von den entstehenden Strömen werden die ermittelten Hintergrundströme subtrahiert [14].
3.1.1 Voltammetrie
Voltammetrische Techniken analysieren Proben an der Oberfläche der implantierten Elektrode. Vor allem die Diffusionseigenschaften der extrazellulären Flüssigkeit und die Reaktionszeit der Elektrode sind verantwortlich dafür, welche Moleküle detektiert werden. Viele Neurotransmitter, darunter Dopamin, Noradrenalin, Adrenalin, Serotonin und Histamin, oxidieren leicht und können daher in voltammetrischen Experimenten nachgewiesen werden [14]. Je nachdem welcher Neurotransmitter erfasst werden soll, werden verschiedene Elektroden verwendet. Es finden unterschiedliche Reaktionen an der Elektrodenoberfläche statt, je nachdem welche Elektroden verwendet werden und wie sie beschichtet sind [13]. Darauf wird im Folgenden noch genauer eingegangen.
Die Voltammetrie liefert dynamische Informationen über die Bewegungsabläufe von Neurotransmittern in ganz bestimmten Bereichen des Gehirns. Die Informationen werden nur aus dem direkten Umfeld der Elektrode gesammelt. So können Unterschiede zwischen den verschiedenen Gehirnregionen untersucht werden [14].
Der große Vorteil der Voltammetrie ist die Vielfältigkeit der gebotenen Informationen. Sie verdeutlicht den Zusammenhang von der Elektrolyserate an der Elektrodenoberfläche und der Transportrate der reagierenden Moleküle, die an die Oberfläche diffundieren. Außerdem liefert sie wichtige Informationen über die Mechanismen und die Anteile der chemischen Reaktionen in Lösungen [15].
Die zeitlichen Veränderungen der Spannung geben hierbei genauere Informationen über die verschiedenen Charaktere der Proben, zum Beispiel molekulare Reaktionen und Diffusionseigenschaften. Dadurch entstehen für jede Elektrode, für jede Beschichtungsart der Elektrode und für jeden Neurotransmitter spezielle, einzigartige Voltammogramme. Hierbei handelt es sich um ein Schaubild des gemessenen Flusses an elektrochemisch aktiven Spezies in Abhängigkeit der angelegten Spannung mit charakteristischen Oxidations- und Reduktionspeaks [13].
Mithilfe dieser Voltammogramme können verschiedene Substanzen identifiziert werden. Jedoch gibt es bei der Bestimmung dieser Stoffe in manchen Fällen Schwierigkeiten bei der quantitativen und qualitativen Beurteilung der Ergebnisse. Zum Beispiel existiert die anionische Form der Ascorbinsäure in vivo in hohen Konzentrationen. Diese Ascorbinsäure besitzt ein Oxidationspotential, das nahe dem des Dopamins und dem des Serotonins bei unveränderten Karbonelektroden liegt, wodurch die Bestimmung der freigesetzten Dopaminmenge erschwert wird. Ascorbinsäure wird daher auch oft als Störstoff gesehen [16].
Ein weiteres Problem ergibt sich beim Vergleich der Konzentrationen. So existiert die Ascorbinsäure in vivo mit einer Konzentration, die zirka 100- bis 1000-mal höher ist, als die der Neurotransmitter. Jedoch gibt es Aspekte, die bei der Neurotransmitterbestimmung ausgenutzt werden können. Es ist wichtig zu wissen, dass Ascorbinsäure (pKS = 4,1) und Harnsäure (pKS = 5,27) bei einem pH-Wert zwischen 5,27 und 8,87 in der anionischen Form vorliegen, während Dopamin (pKB = 8,87) und Serotonin (pKB = 7,59) in der kationischen Form existieren [4].
Bei den voltammetrischen Techniken werden oft Karbon-Nano-Tubes oder Glas-Karbon (Glas-Kohlenstoff) als Elektrodenmaterial eingesetzt [16]. Diese zählen zu einer recht neuen Materialklasse, die auch als Room Temperature Ionic Liquids (RTILs) oder Simply Ionic Liquids (Ils) bezeichnet werden.
Dabei wird Ionic Liquid als Bindemittel für die Karbon-Nano-Tube-Elektroden verwendet. Sie zeichnen sich durch spezifische Eigenschaften wie eine hohe Ionenleitfähigkeit und eine heterozyklische kationische Struktur aus. Weiterhin werden sie bei verschiedensten Spannungswerten verwendet [9]. Ein zusätzlicher Aspekt ist, dass sie sich aufgrund ihrer elektronischen Eigenschaften und ihrer Zusammensetzung als äußerst hilfreich für Elektronenaustauschreaktionen eignen [16]. Sie besitzen zudem ein vorteilhaftes chemisches und physikalisches Verhalten und im Falle von Karbon-Nano-Tubes auch katalytische Eigenschaften [4]. Hierbei dienen die Nanopartikel als elektronische, optische und magnetische Bestandteile des Grundmaterials mit elektrokatalytischen und biokompatiblen Fähigkeiten [10]. Zusätzlich haben sie im Vergleich zu ihrem Volumen kleine Dimensionen und sehr große Oberflächen. Bisher wurden Nanopartikel wie Kadmiumtellurid (CdTe), Gold, Kupfer, Silber oder Nickelhydroxid (Ni(OH)2) mit den Karbon-Nano-Tubes kombiniert.
Die traditionellen Elektrodenoberflächen wie Gold, Kohlenstoff und Graphit wurden schon mit Substanzen wie Nickel, Nickeloxid (NiO), Nickelhydroxid (Ni(OH)2) und Nanoteilchen modifiziert [4]. Es gibt verschiedene Möglichkeiten, um auch Enzyme in die Matrix der Elektrode zu integrieren. So zum Beispiel die Adsorption auf unlösliche Materialien, das Einklemmen in Polymergele, das Einbauen in Membranen, sowie die Vernetzung mit bi- oder mehrfunktionalen Teilnehmern und die Vernetzung mit unlöslichen Aggregatsträgern. Diese Einbindungen der Enzyme erweisen sich als vorteilhaft zur Stabilisierung von Makromolekülen. Weiterhin können die Kosten für die Analyse durch die Enzymintegration stark reduziert werden. Außerdem ist es möglich, den verwendeten Biokatalysator dadurch wieder zurückzugewinnen.
Die Eigenschaften der Enzyme hängen davon ab, auf welcher Trägermatrix sie eingebaut werden. Zur Einbindung und Fixierung dieser Enzyme in die Matrix werden oft Biopolymere, wie Alginat, Chitosan und Chitin verwendet. Sie unterstützen die Enzymimmobilisation aufgrund ihrer Hydrophilität, Biokompatibilität, biologischen Abbaubarkeit und ihrer physikalisch-chemischen Stabilität sehr. Diese Biopolymere erweisen sich als nützlich durch ihre beweglichen, zerstörungssicheren und chemisch inaktiven Eigenschaften. Zudem zählt Chitin zu dem zweit ergiebigsten Naturbiopolymer. Es hat exzellente Materialeigenschaften, wie Biokompatibilität, biologische Abbaubarkeit, chemische und physikalische Stabilitäten und es ist nicht giftig.
Wie zuvor schon erwähnt, ist das Ziel der elektrochemischen Methoden, die Kosten zu minimieren, sowie die Sensitivität des Sensors bei geringeren Untersuchungszeiten zu steigern. Hierzu ist das Verwenden von Zellfraktionen und Pflanzengewebe auch von besonderer Bedeutung. Sie haben attraktive analytische Eigenschaften wie Einfachheit, Stabilität, lange Lebensdauer, geringe Kosten und geringe Anforderungen [9].
Durch die im Folgenden beschriebenen, unterschiedlichen Scan-Arten und verschiedenen Elektroden, bei denen die Potentialveränderungen über die Zeit variiert werden, lassen sich unterschiedliche physikalische Phänomene beobachten [15].
Im Vergleich zur später beschriebenen Mikrodialyse, sind die voltammetrischen Messungen schneller und benötigen kleinere Proben, was natürlich mit weniger Gewebeverletzungen verbunden ist. Zusätzlich kann ein gezielter Bereich im Gehirn angesteuert und die dortige Neurotransmitterkonzentration bestimmt werden. Im Gegensatz dazu ist die Mikrodialyse aber sensitiver und selektiver [6, 11].
Zyklische Voltammetrie (CV)
Die zyklische Voltammetrie bildet die Grundlage für alle weiteren voltammetrischen Methoden. Sie nutzt eine Arbeitselektrode, an der eine elektrische Spannung (auch als Potential bezeichnet) angelegt wird. Dieses wechselt kontinuierlich linear mit geringer Frequenz zwischen einem oxidierenden und einem reduzierenden Potential. Dies geschieht zum Beispiel bei der Dopaminerfassung mit einem anodischen Anstieg von -400 mV auf +1000 mV, gefolgt von einem kathodischen Abfall von +1000 mV auf -400 mV. Das Potential an dem sich die Scan-Richtung ändert, in diesem Fall +1000 mV, wird Umkehrpotential genannt. Es entsteht ein Kreislauf zwischen Oxidation und Reduktion (daher die Bezeichnung zyklische Voltammetrie). Der lineare Anstieg und Abfall des Potentials über die Zeit ergibt eine Kurve in V-Form (Abb. 1). Durch die Oxidations- und Reduktionsreaktionen entstehen Ströme, welche durchgängig aufgezeichnet werden.

Abb. 1: V-förmiges Spannungspotential der zyklischen Voltammetrie [17]
Diese Messergebnisse, das Voltammogramm, zeigt in Abhängigkeit von der angelegten Spannung charakteristische Oxidations- und Reduktionspeaks. Der Potentialbereich wird so eingegrenzt, dass Oxidation und Reduktion des gesuchten Stoffs im Potentialzwischenraum liegen [8], zum Beispiel zwischen -200 mV und 1000 mV [16]. Anhand der Position der Peaks kann abgelesen werden, welcher Stoff nachgewiesen wurde.
Hilfreich ist dabei auch, wenn mit den ermittelten Daten die Adsorptions- und Desorptionseigenschaften bestimmt werden, da diese wiederum spezifisch auf bestimmte Stoffe hindeuten [18]. Zudem liefert der Mittelpunkt der beiden Peaks die wichtige thermodynamische Größe E0, die Hinweise auf den detektierte Stoff liefert, beispielsweise durch Ausschluss zahlreicher anderer Moleküle [14]. Der gemessene Stromfluss sowie das Erfassungslimit sind durch die Massenübertragungsrate der Elektrode begrenzt. Das heißt, dass die Elektrode nur die Moleküle registriert, die an ihrer Oberfläche reagieren.
Überschneiden sich die Potentialbereiche von mehreren Neurotransmittern, vermindert dies die Nachweissicherheit für bestimmte Neurotransmitter. Es muss somit von Ungenauigkeiten in den Messungen ausgegangen werden. Ist bekannt, um welchen störenden Stoff es sich handelt, und gibt es eine Möglichkeit, dessen Konzentration mit einer anderen Methode zu bestimmen, so können beide Messungen gleichzeitig durchgeführt und im Anschluss gegeneinander abgeglichen werden.
Dopaminerfassung mit zyklischer Voltammetrie
Mit der zyklischen Voltammetrie lassen sich direkte Messungen von Dopamin mit einer hohen Genauigkeit und relativ einfacher Handhabung durchführen [8]. Dabei können mit Glas-Karbon-Elektroden Erfassungsgrenzen im Bereich von 3,0 x 10-7 bis 1,0 x 10-6 mol/l für Dopamin erzielt werden. Die Erfassungsgrenze, die Sensitivität und die Selektivität der Elektroden ist durch eine Verbesserung der elektrokatalytischen Eigenschaften im positiven Sinne beeinflussbar. Die Karbon-Nano-Tube-Elektroden finden häufig Anwendung bei der Erfassung von Dopamin, Adrenalin und Serotonin [16]. Dopamin kann zum Beispiel mit folgenden verschiedenen Elektroden erfasst werden:
- Multi-Wall-Carbon-Nanotubes-Pasten-Elektrode, beschichtet mit Eisen(II)-
Phthalocyanin (FePc MWCNTPEs) [16] - Glas-Kohlenstoff-Elektrode, beschichtet mit Gold-Nanocluster/overoxidized-
polypyrole (GCE nano-Au/PPyox) [10] - Multi-Wall-Carbon-Nanotubes-Glaselektrode, beschichtet mit einem Nafion/Ni(OH)2-Gemisch (MWNTs/GCE(Nafion/Ni(OH)2)) [4]
Diese Elektroden werden im Folgenden genauer betrachtet.
Multi-Wall-Carbon-Nano-Tube-Pasten-Elektrode FePc MWCNTPEs
Die Eisen(II)Phthalocyanin-Beschichtung bei Muti-Wall-Karbon-Nano-Tube-Pasten-Elektroden ist hilfreich bei der Separation der Oxidationspotentiale von Ascorbinsäure und Dopamin. Dadurch entsteht ein qualitativ und quantitativ hochwertiges Ergebnis. Durch Einbau von Eisen(II)Phthalocyanin in die Nano-Tubes verbessern sich die elektrische Leitfähigkeit sowie der Oxidationsfluss für Dopamin, aufgrund von erhöhten katalytischen Aktivitäten.
Der Oxidationsfluss hat bei einem Gewichtsprozent von 1 % Eisen(II)Phthalocyanin ein Maximum. Dies ist in Abbildung 2 bei einer Spannung von 230 mV für eine Elektrode mit 1 % Eisen(II)Phthalocyanin erkennbar. Bei höheren oder geringeren Gewichtsprozenten an Eisen(II)Phthalocyanin nimmt die Menge des oxidierten Dopamins ab. Zusätzlich verändert sich auch die Spannung, bei welcher der Oxidationsspitzenwert lokalisiert wird. Bei einer nicht modifizierten Elektrode (a) werden geringere Oxdiationsspitzenwerte erreicht als bei behandelten (b). Zudem sind die Maxima bei diesen beiden Elektroden an unterschiedlichen Stellen lokalisiert.

Abb. 2: Zyklisches Voltammogramm von 1,0 x 10-3 mol/l Dopamin in einem Phosphatpuffer mit einem pH-Wert von 7: (a) unveränderte Elektrode (b) mit einer 1%igen FePc-MWCNTP-Elektrode [16]
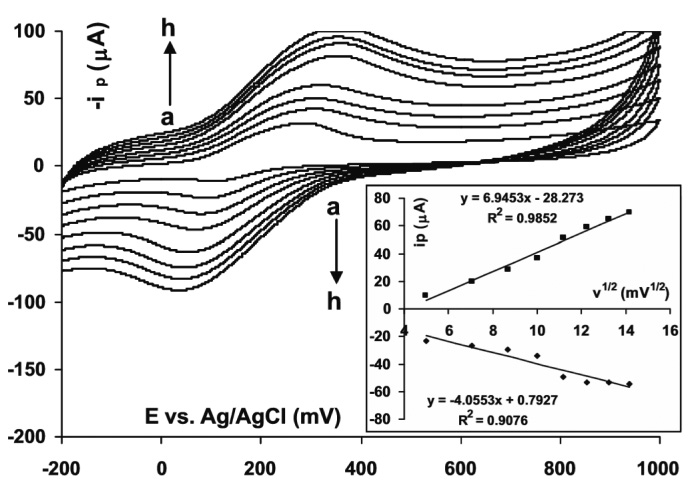
Abb. 3: Zyklisches Voltammogramm von 1,0 x 10-3 mol/l Dopamin in einem Phosphatpuffer mit pH 7,4 unter Verwendung einer 1%igen FePc-MWCNTP-Elektrode bei verschiedenen Abtastraten zwischen (a) 25 mV/s und (h) 200 mV/s; die kleine Grafik zeigt den Zusammenhang zwischen Spitzenfluss und Quadratwurzel der Abtastrate [16]
Die Lage des Oxidationsspitzenwerts wird hierbei von den gewählten Untersuchungsbedingungen beeinflusst; sie sind zu berücksichtigen. Der anodische und kathodische Spitzenfluss verändern sich direkt, linear mit der Quadratwurzel der Abtastrate in einem Bereich von 25 mV/s und 200 mV/s. Je höher die Abtastrate ist, desto höher sind auch die anodischen und kathodischen Spitzenflüsse und umgekehrt. Abbildung 3 zeigt zyklische Voltammogramme von Dopamin bei unterschiedlichen Abtastraten, aus denen diese Abhängigkeit ersichtlich ist. Gezeigt ist auch (kleine Grafik) der lineare Zusammenhang zwischen dem Spitzenfluss und der Quadratwurzel der Potential-Abtastrate.
Weiterhin gibt es einen linearen Zusammenhang zwischen der Dopaminkonzentration und der Spitzenflussintensität von Dopamin in einem Bereich von 0,5 x 10-6 mol/l und 8,85 x 10-6 mol/l. Je höher die Dopaminkonzentration, desto höher ist auch die Intensität des Spitzenflusses. Ein weiterer Parameter ist der pH-Wert. Bei der FePc MWCNTP-Elektrode wird bei einem pH-Wert von 7,4 eine maximale Menge an Dopamin freigesetzt.
Mit dieser leicht herzustellenden Elektrode und entsprechenden Parametereinstellungen kann eine Erfassungsgrenze von 2,05 x 10-7 mol/l für Dopamin erreicht werden. Dies entspricht einer exzellenten Sensitivität und einer geringen Erfassungsgrenze. Das Erfassen von Dopamin ist auch mit leicht veränderten FePc MWCNTP-Elektroden möglich, beispielsweise einer Glas-Karbon-Elektrode mit einer Beschichtung aus Tetraaminophthalocaninnickel (NiIITAPc), bei welcher der Redoxübergang von Fe(III)/Fe(II) relevant ist.
Eine weitere, leicht veränderte Elektrode zur Erfassung von Dopamin ist die Karbon-Pasten-Elektrode, die mit einem kationischen Oberflächenmittel Cetyltrimethylammonium-Bromid (CTAB) und Eisen(II)-
Octanitro-Phthalocyanin modifiziert ist. Diese Elektrode kann gleichzeitig Ascorbinsäure, Harnsäure und Dopamin erfassen. Durch das Oberflächenmittel Cetyltrimethylammonium-Bromid können die Anodenspitzenpotentiale von Dopamin und Ascorbinsäure separiert und diese Substanzen getrennt in einem Voltammogramm, mit akzeptabler Empfindlichkeitsgrenze, aufgezeichnet werden [16].
-wird fortgesetzt-
Literatur
[1] W. de Gruyter, Ed.: Pschyrembel Klinisches Wörterbuch; 259th ed. Berlin, Walter de Gruyter GmbH & Co. KG, 2002
[2] DocCheck Flexikon, Neurotransmitter: Neurotransmitter 1; available: http://flexikon.doccheck.com/de/Neurotransmitter (2014, Jan., 06)
[3] U. Pontes, Neurotransmitter – Botenmoleküle im Gehirn: Neurotransmitter 2; available: http://dasgehirn.info/entdecken/kommunikation-der-zellen/neurotransmitter-2013-botenmolekuele-im-gehirn-5880/ (2012, Apr., 16)
[4] Ali Babaei, Ali Reza Taheri: Nafion/Ni(OH)2 nanoparticles-carbon nanotube composite modified glassy carbon electrode as a sensor for simultaneous determination of dopamine and serotonin in the presence of ascorbic acid; (en), Sensors and Actuators B, no. 176, pp. 543–551, http://www.sciencedirect.com/science/article/pii/S0925400512009331, 2013
[5] R. N. Goyal, S. P. Singh: Simultaneous voltammetric determination of dopamine and adenosine using a single walled carbon nanotube – Modified glassy carbon electrode; (en), Carbon, no. 46, pp. 1556–1562, http://www.sciencedirect.com/science/article/pii/S0008622308003308, 2008
[6] Van Gompel, Jamie J, S.-Y. Chang, S. J. Goerss, I. Y. Kim, C. Kimble, K. E. Bennet, K. H. Lee: Development of intraoperative electrochemical detection: wireless instantaneous neurochemical concentration sensor for deep brain stimulation feedback; Neurosurg Focus, vol. 2, no. 29, pp. E6, http://www.ncbi.nlm.nih.gov/pubmed/20672923, 2010
[7] netdoktor, Neurotransmitter: Neurotranmitter 3; available: http://www.netdoktor.at/laborwerte/neurotransmitter-8379 (2014, Feb., 01)
[8] K. Jackowska, P. Krysinski: New trends in the electrochemical sensing of dopamine; (en), Anal Bioanal Chem, vol. 11, no. 405, pp. 3753–3771, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3608872/, 2013
[9] D. Brondani, J. Dupont, A. Spinelli, I. Cruz Vieira: Development of biosensor based on ionic liquid and corn peroxidase immobilized on chemically crosslinked chitin; (en), Sensors and Actuators B, no. 138, pp. 236–243, http://www.sciencedirect.com/science/article/pii/S0925400508008368, 2009
[10] Jing Li, Xiangqin Lin; Simultaneous determination of dopamine and serotonin on gold nanocluster/overoxidized-polypyrrole composite modified glassy carbon electrode; (en), Sensors and Actuators B, no. 124, pp. 486–493, http://www.sciencedirect.com/science/article/pii/S0925400507000226, 2007
[11] K. H. Lee, C. D. Blaha, P. A. Garris, P. Mohseni, A. E. Horne, K. E. Bennet, F. Agnesi, J. M. Bledsoe, D. B. Lester, C. Kimble, H.-K. Min, Y.-B. Kim, Z.-H. Cho: Evolution of Deep Brain Stimulation: Human Electrometer and Smart Devices Supporting the Next Generation of Therapy; (en), Neuromodulation, vol. 2, no. 12, pp. 85–103, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2908254/, 2009
[12] P. Vanden Berghe: Electrochemical detection of neurotransmitters in the gut wall; (en), Neurogastroenterol Motil, no. 20, pp. 1185–1188, http://onlinelibrary.wiley.com/doi/10.1111/j.1365-2982.2008.01207.x/full#ss3, 2008
[13] E. Kätelhön, B. Wolfrum: On-chip redox cycling techniques for electrochemical detection; (en), Reviews in Analytical Chemistry, pp. 7–14, http://www.degruyter.com/view/j/revac.2012.31.issue-1/revac-2011-0031/
revac-2011-0031.xml, 2012
[14] K. T. Kawagoe, J. B. Zimmerman, R. M. Wightman: Principles of voltammetry and microelectrode surface states; (en), Journal of Neuroscience Methods, no. 48, pp. 225–240, http://www.sciencedirect.com/science/
article/pii/0165027093900948#, 1993
[15] E. Dickinson: Modeling Electroanalysis: Cyclic Voltammetry; available: http://www.comsol.de/blogs/modeling-electroanalysis-cyclic-voltammetry/ (2014, Jul., 28)
[16] D. Patrascua, I. David, V. David, C. Mihailciuc, I. Stamatin, J. Ciurea, L. Nagy, G. Nagy, A. Alexandru Ciucu: Selective voltammetric determination of electroactive neuromodulating species in biological samples using iron(II) phthalocyanine modified multi-wall carbon nanotubes paste electrode; (en), Sensors and Actuators B, no. 156, pp. 731–736, 2011
[17] T. M. Paschkewitz: Cyclic Voltammetry Waveform; available: http://en.wikipedia.org/w/index.php?oldid=468490058 (2014, Jul., 28)
[18] D. P. Jang, I. Kim, S.-Y. Chang, H.-K. Min, K. Arora, M. P. Marsh, S.-C. Hwang, C. J. Kimble, K. E. Bennet, K. H. Lee: Paired pulse voltammetry for differentiating complex analytes; (en), Analyst, vol. 6, no. 137, pp. 1428–1435, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3349343/, 2012
DOI: 10.7395/2016/Rech01




